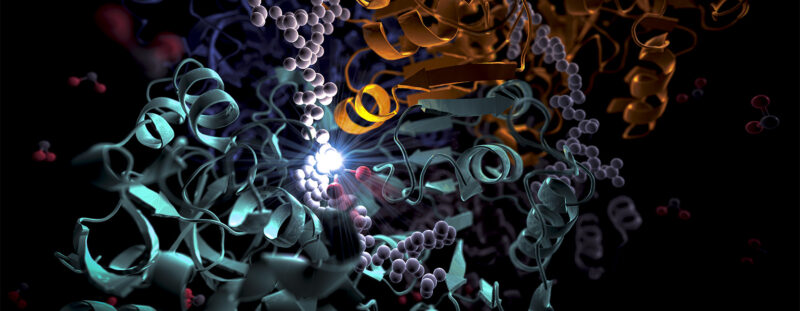
Interprétation artistique de l’enzyme Crédit : SLAC National Accelerator Laboratory
Des chercheurs découvrent qu’un point de colle moléculaire et une tournure opportune aident une enzyme bactérienne à convertir le dioxyde de carbone en composés carbonés 20 fois plus vite que ne le font les enzymes végétales pendant la photosynthèse. Ces résultats devraient permettre d’accélérer les progrès dans la conversion du dioxyde de carbone en divers produits.
La fixation du carbone, ou la conversion du dioxyde de carbone de l’air en biomolécules riches en carbone, est essentielle à la survie des plantes. C’est tout l’intérêt de la photosynthèse et la pierre angulaire du vaste système interdépendant qui assure le cycle du carbone à travers les plantes, les animaux, les microbes et l’atmosphère pour maintenir la vie sur Terre.
Les champions de la fixation du carbone sont toutefois des bactéries du sol, et non des plantes. Les scientifiques pourraient être en mesure de développer une photosynthèse artificielle pour convertir les gaz à effet de serre en carburants, engrais, antibiotiques et autres produits s’ils parviennent à comprendre comment certaines enzymes bactériennes réalisent une étape vitale de la fixation du carbone 20 fois plus rapidement que les enzymes végétales.
Une équipe de chercheurs du SLAC National Accelerator Laboratory du ministère de l’énergie, de l’université de Stanford, de l’Institut Max Planck de microbiologie terrestre en Allemagne, du Joint Genome Institute (JGI) du ministère de l’énergie et de l’université de Concepción au Chili a découvert comment une enzyme bactérienne – une machine moléculaire qui facilite les réactions chimiques – s’active pour réaliser cet exploit.
Plutôt que de saisir des molécules de dioxyde de carbone et de les attacher à des biomolécules une par une, ils ont découvert que cette enzyme est constituée de paires de molécules qui travaillent de manière synchronisée, comme les mains d’un jongleur qui lance et attrape simultanément des balles pour accomplir son travail plus rapidement. L’un des membres de chaque paire d’enzymes s’ouvre largement pour attraper un ensemble d’ingrédients réactionnels, tandis que l’autre se referme sur les ingrédients qu’il a capturés et effectue la réaction de fixation du carbone ; ensuite, ils changent de rôle dans un cycle continu.
L’équipe a découvert qu’un seul point de “colle” moléculaire maintient ensemble chaque paire de mains enzymatiques afin qu’elles puissent alternativement s’ouvrir et se fermer de manière coordonnée, tandis qu’un mouvement de torsion permet de faire entrer et sortir les ingrédients et les produits finis des poches où se déroulent les réactions. Lorsque la colle et la torsion sont toutes deux présentes, la réaction de fixation du carbone se déroule 100 fois plus vite que sans elles.

Cette animation montre deux des molécules appariées (bleu et blanc) de l’enzyme ECR, qui fixe le carbone dans les microbes du sol, en action. Elles travaillent ensemble, comme les mains d’un jongleur qui lance et attrape simultanément des balles, pour accomplir le travail plus rapidement. L’un des membres de chaque paire d’enzymes s’ouvre largement pour attraper un ensemble d’ingrédients réactionnels (que l’on voit arriver par le haut et le bas), tandis que l’autre se referme sur les ingrédients qu’il a capturés et effectue la réaction de fixation du carbone ; ensuite, ils changent de rôle dans un cycle continu. Les scientifiques tentent d’exploiter et d’améliorer ces réactions pour la photosynthèse artificielle afin de fabriquer divers produits. Crédit : H. DeMirci et al, ACS Central Science, 2022
“Cette enzyme bactérienne est le fixateur de carbone le plus efficace que nous connaissions, et nous avons trouvé une explication claire de ce qu’elle peut faire”, a déclaré Soichi Wakatsuki, professeur au SLAC et à Stanford et l’un des principaux responsables de l’étude, qui a été publiée dans la revue ACS Central Science. ACS Central Science cette semaine.
“Certaines enzymes de cette famille agissent lentement mais de manière très spécifique pour produire un seul produit”, a-t-il déclaré. “D’autres sont beaucoup plus rapides et peuvent fabriquer des blocs de construction chimiques pour toutes sortes de produits. Maintenant que nous connaissons le mécanisme, nous pouvons concevoir des enzymes qui combinent les meilleures caractéristiques des deux approches et font un travail très rapide avec toutes sortes de matériaux de départ.”
Améliorer la nature
L’enzyme étudiée par l’équipe fait partie d’une famille appelée enoyl-CoA carboxylases/réductases, ou ECRs. Elle provient de bactéries du sol appelées Kitasatospora setae, qui, en plus de leur capacité à fixer le carbone, peuvent également produire des antibiotiques.
Wakatsuki a entendu parler de cette famille d’enzymes il y a une demi-douzaine d’années par Tobias Erb de l’Institut Max Planck de microbiologie terrestre en Allemagne et Yasuo Yoshikuni du JGI. L’équipe de recherche d’Erb travaillait à la mise au point de bioréacteurs pour la photosynthèse artificielle afin de convertir le dioxyde de carbone (CO2) de l’atmosphère en toutes sortes de produits.
Aussi importante que soit la photosynthèse pour la vie sur Terre, dit Erb, elle n’est pas très efficace. Comme toutes les choses façonnées par l’évolution au cours des éons, elle n’est que ce qu’elle a besoin d’être, le résultat d’un lent processus de transformation.en s’appuyant sur des développements antérieurs, mais sans jamais inventer quelque chose d’entièrement nouveau à partir de zéro.

Une vue rapprochée de Kitasatospora setae, une bactérie isolée du sol au Japon. Ces bactéries fixent le carbone – transforment le dioxyde de carbone de leur environnement en biomolécules dont elles ont besoin pour survivre – grâce à des enzymes appelées ECR. Les chercheurs cherchent des moyens d’exploiter et d’améliorer les ECR pour la photosynthèse artificielle afin de produire des carburants, des antibiotiques et d’autres produits. Crédit : Y. Takahashi & ; Y. Iwai, atlas.actino.jp
De plus, a-t-il ajouté, l’étape de la photosynthèse naturelle qui consiste à fixer le CO2 de l’air, et qui repose sur une enzyme appelée Rubisco, est un goulot d’étranglement qui ralentit toute la chaîne des réactions photosynthétiques. L’utilisation d’enzymes ECR rapides pour réaliser cette étape, et leur ingénierie pour qu’elles soient encore plus rapides, pourrait donc permettre d’améliorer considérablement l’efficacité.
“Nous n’essayons pas de faire une copie carbone de la photosynthèse”, explique Erb. “Nous voulons concevoir un processus beaucoup plus efficace en utilisant notre compréhension de l’ingénierie pour reconstruire les concepts de la nature. Cette ‘photosynthèse 2.0’ pourrait avoir lieu dans des systèmes vivants ou synthétiques tels que des chloroplastes artificiels – des gouttelettes d’eau en suspension dans l’huile.”
Portraits d’une enzyme
Wakatsuki et son groupe avaient étudié un système connexe, la fixation de l’azote, qui convertit l’azote gazeux de l’atmosphère en composés dont les êtres vivants ont besoin. Intrigué par la question de savoir pourquoi les enzymes ECR étaient si rapides, il a commencé à collaborer avec le groupe d’Erb pour trouver des réponses.
Hasan DeMirci, un associé de recherche du groupe de Wakatsuki qui est maintenant professeur adjoint à l’Université Koc et chercheur à l’Institut PULSE de Stanford, a dirigé les travaux au SLAC avec l’aide d’une demi-douzaine de stagiaires d’été du SLAC qu’il a supervisés. “Nous formons six ou sept d’entre eux chaque année, et ils n’avaient peur de rien”, a-t-il déclaré. “Ils sont venus l’esprit ouvert, prêts à apprendre, et ils ont fait des choses étonnantes”.
L’équipe SLAC a fabriqué des échantillons de l’enzyme ECR et les a cristallisés pour les examiner aux rayons X à l’Advanced Photon Source de l’Argonne National Laboratory du DOE. Les rayons X ont révélé la structure moléculaire de l’enzyme, c’est-à-dire l’agencement de son échafaudage atomique, à la fois seul et lorsqu’il est attaché à une petite molécule auxiliaire qui facilite son travail.
D’autres études aux rayons X menées au Stanford Synchrotron Radiation Lightsource (SSRL) du SLAC ont montré comment la structure de l’enzyme se modifie lorsqu’elle est attachée à un substrat, une sorte de banc de travail moléculaire qui assemble les ingrédients de la réaction de fixation du carbone et stimule la réaction.

Cette représentation de l’ECR, une enzyme présente dans les bactéries du sol, montre chacune de ses quatre molécules identiques dans une couleur différente. Ces molécules travaillent ensemble par paires – le bleu avec le blanc et le vert avec l’orange – pour transformer le dioxyde de carbone de l’environnement du microbe en biomolécules dont il a besoin pour survivre. Une nouvelle étude montre qu’un point de colle moléculaire et une rotation opportune permettent à ces paires de synchroniser leurs mouvements et de fixer le carbone 20 fois plus vite que ne le font les enzymes végétales pendant la photosynthèse. Crédit : H. DeMirci et al, ACS Central Science, 2022
Enfin, une équipe de chercheurs du Linac Coherent Light Source (LCLS) du SLAC a effectué des études plus détaillées de l’enzyme et de son substrat au laser à électrons libres à rayons X SACLA du Japon. Le choix d’un laser à rayons X était important car il leur a permis d’étudier le comportement de l’enzyme à température ambiante – plus proche de son environnement naturel – sans pratiquement subir de dommages dus aux rayonnements.
Pendant ce temps, le groupe d’Erb en Allemagne et le groupe du professeur associé Esteban Vo¨hringer-Martinez à l’Université de Concepción au Chili ont mené des études biochimiques détaillées et des simulations dynamiques approfondies pour donner un sens aux données structurelles recueillies par Wakatsuki et son équipe.
Les simulations ont révélé que l’ouverture et la fermeture des deux parties de l’enzyme n’impliquent pas seulement une colle moléculaire, mais aussi des mouvements de torsion autour de l’axe central de chaque paire d’enzymes, a déclaré Wakatsuki.
“Cette torsion est presque comme un rachet qui peut pousser un produit fini vers l’extérieur ou attirer un nouvel ensemble d’ingrédients dans la poche où la réaction a lieu”, a-t-il expliqué. Ensemble, la torsion et la synchronisation des paires d’enzymes leur permettent de fixer le carbone 100 fois par seconde.
La famille des enzymes ECR comprend également une branche plus polyvalente qui peut interagir avec de nombreux types de biomolécules pour produire une variété de produits. Mais comme elles ne sont pas maintenues ensemble par une colle moléculaire, elles ne peuvent pas coordonner leurs mouvements et fonctionnent donc beaucoup plus rapidement.lentement.
“Si nous pouvons augmenter le taux de ces réactions sophistiquées pour fabriquer de nouvelles biomolécules”, a déclaré Wakatsuki, “ce serait un saut significatif dans le domaine.”
Des plans statiques aux films fluides
Jusqu’à présent, les expériences ont produit des clichés statiques de l’enzyme, des ingrédients de la réaction et des produits finaux dans diverses configurations.
“Notre expérience de rêve”, a déclaré Wakatsuki, “serait de combiner tous les ingrédients au fur et à mesure qu’ils s’écoulent dans la trajectoire du faisceau laser à rayons X, afin de pouvoir observer la réaction se dérouler en temps réel.”
L’équipe a essayé cela à SACLA, mais cela n’a pas fonctionné. “Les molécules de CO2 sont vraiment petites, et elles se déplacent si rapidement qu’il est difficile de saisir le moment où elles se fixent au substrat”, a-t-il dit. “De plus, le faisceau laser à rayons X est si puissant que nous n’avons pas pu y maintenir les ingrédients assez longtemps pour que la réaction ait lieu. Lorsque nous avons appuyé fort pour y parvenir, nous avons réussi à briser les cristaux.”
Une prochaine mise à niveau à haute énergie du LCLS résoudra probablement ce problème, a-t-il ajouté, avec des impulsions qui arrivent beaucoup plus fréquemment – un million de fois par seconde – et qui peuvent être ajustées individuellement à la force idéale pour chaque échantillon.
Wakatsuki a déclaré que son équipe continue de collaborer avec le groupe d’Erb, et qu’elle travaille avec le groupe de livraison des échantillons du LCLS et avec les chercheurs des installations de microscopie électronique cryogénique (cryo-EM) de SLAC-Stanford pour trouver un moyen de faire fonctionner cette approche.
Des chercheurs du RIKEN Spring-8 Center et de l’Institut japonais de recherche sur le rayonnement synchrotron ont également contribué à ces travaux, qui ont bénéficié d’un financement important du DOE Office of Science. Une grande partie du travail préliminaire de cette étude a été réalisée par Yash Rao, stagiaire d’été du SLAC ; les stagiaires Brandon Hayes, E. Han Dao et Manat Kaur ont également apporté des contributions importantes. Le Joint Genome Institute du DOE a fourni le DNA used to produce the ECR samples. SSRL, LCLS, the Advanced Photon Source and the Joint Genome Institute are all DOE Office of Science user facilities.
Reference: “Intersubunit Coupling Enables Fast CO2-Fixation by Reductive Carboxylases” by Hasan DeMirci, Yashas Rao, Gabriele M. Stoffel, Bastian Vögeli, Kristina Schell, Aharon Gomez, Alexander Batyuk, Cornelius Gati, Raymond G. Sierra, Mark S. Hunter, E. Han Dao, Halil I. Ciftci, Brandon Hayes, Fredric Poitevin, Po-Nan Li, Manat Kaur, Kensuke Tono, David Adrian Saez, Samuel Deutsch, Yasuo Yoshikuni, Helmut Grubmüller, Tobias J. Erb, Esteban Vöhringer-Martinez and Soichi Wakatsuki, 25 April 2022, ACS Central Science.
DOI: 10.1021/acscentsci.2c00057