Les découvertes pourraient conduire à une approche ciblée pour traiter le vieillissement.
Des recherches menées par l’Institut Babraham ont permis de mettre au point une méthode permettant de “sauter dans le temps” les cellules de la peau humaine de 30 ans, en faisant reculer l’horloge du vieillissement des cellules sans perdre leur fonction spécialisée. Les travaux des chercheurs du programme de recherche en épigénétique de l’Institut ont permis de restaurer en partie la fonction des cellules âgées et de rajeunir les mesures moléculaires de l’âge biologique. La recherche est publiée aujourd’hui (7 avril 2022) dans la revue eLife et bien qu’à un stade précoce d’exploration, elle pourrait révolutionner la médecine régénérative.
Qu’est-ce que la médecine régénérative ?
En vieillissant, la capacité de nos cellules à fonctionner diminue et le génome accumule les marques du vieillissement. La biologie régénérative vise à réparer ou à remplacer les cellules, y compris les anciennes. L’un des outils les plus importants de la biologie régénérative est notre capacité à créer des cellules souches “induites”. Le processus est le résultat de plusieurs étapes, chacune effaçant certaines des marques qui rendent les cellules spécialisées. En théorie, ces cellules souches ont le potentiel de devenir n’importe quel type de cellule, mais les scientifiques ne sont pas encore en mesure de recréer de manière fiable les conditions permettant de redifférencier les cellules souches en tous types de cellules.
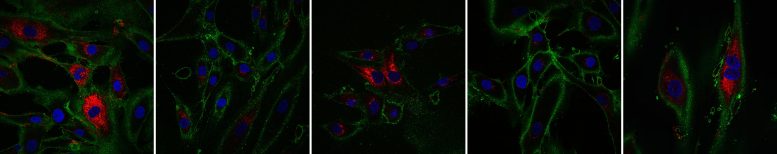
Jeunes fibroblastes dans la première image, les deux autres sont après 10 jours, à droite avec traitement, les deux derniers sont après 13 jours, à droite avec traitement. Le rouge montre la production de collagène qui a été restaurée. Crédit : Fátima Santos, Institut Babraham
Revenir en arrière
La nouvelle méthode, basée sur la technique primée par le prix Nobel que les scientifiques utilisent pour fabriquer des cellules souches, permet de surmonter le problème de l’effacement complet de l’identité cellulaire en interrompant la reprogrammation à mi-chemin du processus. Cela a permis aux chercheurs de trouver un équilibre précis entre la reprogrammation des cellules, qui les rend biologiquement plus jeunes, et la possibilité de retrouver leur fonction cellulaire spécialisée.
En 2007, Shinya Yamanaka a été le premier scientifique à transformer des cellules normales, qui ont une fonction spécifique, en cellules souches qui ont la capacité spéciale de se développer en n’importe quel type de cellule. Le processus complet de reprogrammation des cellules souches prend environ 50 jours et fait appel à quatre molécules clés appelées “facteurs de Yamanaka”. La nouvelle méthode, appelée “reprogrammation transitoire en phase de maturation”, expose les cellules aux facteurs de Yamanaka pendant 13 jours seulement. À ce stade, les changements liés à l’âge sont supprimés et les cellules ont temporairement perdu leur identité. Les cellules partiellement reprogrammées ont eu le temps de se développer dans des conditions normales, afin d’observer si leur fonction spécifique de cellule de peau revenait. L’analyse du génome a montré que les cellules avaient retrouvé les marqueurs caractéristiques des cellules de la peau (fibroblastes), ce qui a été confirmé par l’observation de la production de collagène dans les cellules reprogrammées.
Migration de cellules fibroblastes dans le cadre d’un essai de cicatrisation. Crédit : Fátima Santos, analyse par Hanneke Okkenhaug.
L’âge n’est pas qu’un chiffre
Pour montrer que les cellules avaient été rajeunies, les chercheurs ont recherché des changements dans les signes du vieillissement. Comme l’explique le Dr Diljeet Gill, postdoc dans le laboratoire de Wolf Reik à l’Institut, qui a mené les travaux en tant que doctorant : “Notre compréhension du vieillissement au niveau moléculaire a progressé au cours de la dernière décennie, donnant lieu à des techniques qui permettent aux chercheurs de mesurer les changements biologiques liés à l’âge dans les cellules humaines. Nous avons pu appliquer ces techniques à notre expérience pour déterminer l’ampleur de la reprogrammation obtenue par notre nouvelle méthode.”

Dr. Diljeet Gill. Crédit : Institut Babraham
Les chercheurs ont examiné plusieurs mesures de l’âge cellulaire. La première est l’horloge épigénétique, où les étiquettes chimiques présentes dans le génome indiquent l’âge. La seconde est le transcriptome, c’est-à-dire toutes les lectures de gènes produites par la cellule. Selon ces deux mesures, les cellules reprogrammées correspondaient au profil de cellules 30 ans plus jeunes par rapport à des ensembles de données de référence.
Les applications potentielles de cette technique dépendent du fait que les cellules ne doivent pas seulement paraître plus jeunes, mais aussi fonctionner comme des cellules jeunes. Les fibroblastes produisent du collagène, une molécule présente dans les os, les tendons de la peau et les ligaments, qui contribue à structurer les tissus et à guérir les blessures. Les fibroblastes rajeunis ont produit davantage de protéines de collagène que les cellules témoins qui n’ont pas subi le processus de reprogrammation. Les fibroblastes se déplacent également dans les zones qui ont besoin d’être réparées. Les chercheurs ont testé les cellules partiellement rajeunies en créant une coupure artificielle dans une couche de cellules dans un plat. Ils ont constaté que les cellules traitéesLes fibroblastes se sont déplacés dans l’espace plus rapidement que les cellules plus anciennes. C’est un signe prometteur qu’un jour cette recherche pourrait être utilisée pour créer des cellules plus aptes à guérir les blessures.
À l’avenir, cette recherche pourrait également ouvrir d’autres possibilités thérapeutiques ; les chercheurs ont observé que leur méthode avait également un effet sur d’autres gènes liés aux maladies et symptômes liés à l’âge. Le site APBA2 associé à Alzheimer’s disease, and the MAF gene with a role in the development of cataracts, both showed changes towards youthful levels of transcription.
The mechanism behind the successful transient reprogramming is not yet fully understood, and is the next piece of the puzzle to explore. The researchers speculate that key areas of the genome involved in shaping cell identity might escape the reprogramming process.
Diljeet concluded: “Our results represent a big step forward in our understanding of cell reprogramming. We have proved that cells can be rejuvenated without losing their function and that rejuvenation looks to restore some function to old cells. The fact that we also saw a reverse of aging indicators in genes associated with diseases is particularly promising for the future of this work.”
Professor Wolf Reik, a group leader in the Epigenetics research program who has recently moved to lead the Altos Labs Cambridge Institute, said: “This work has very exciting implications. Eventually, we may be able to identify genes that rejuvenate without reprogramming, and specifically target those to reduce the effects of aging. This approach holds promise for valuable discoveries that could open up an amazing therapeutic horizon.”
Reference: “Multi-omic rejuvenation of human cells by maturation phase transient reprogramming” 7 April 2022, eLife.
DOI: 10.7554/eLife.71624