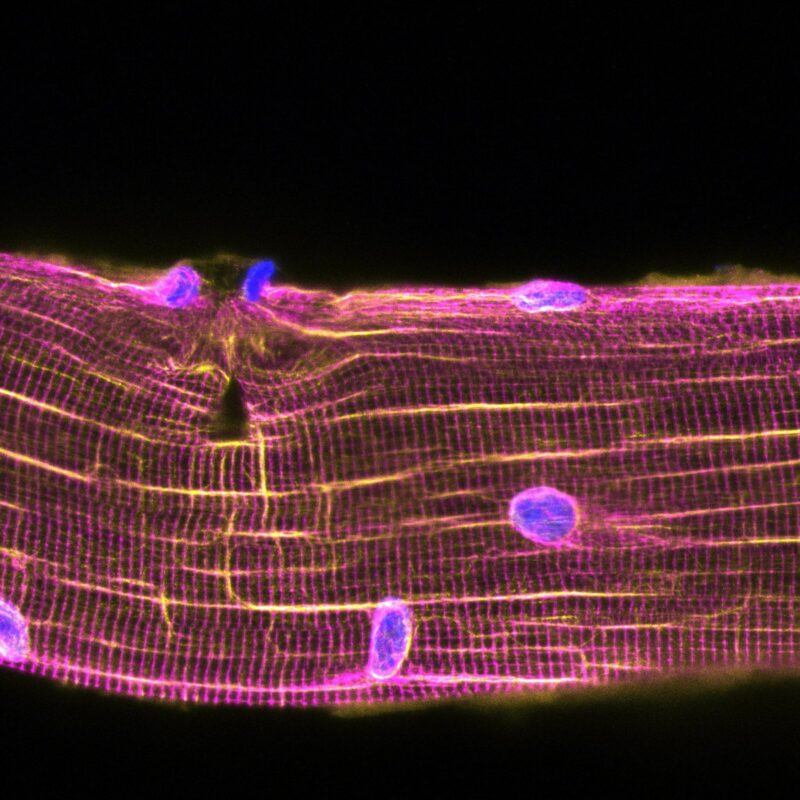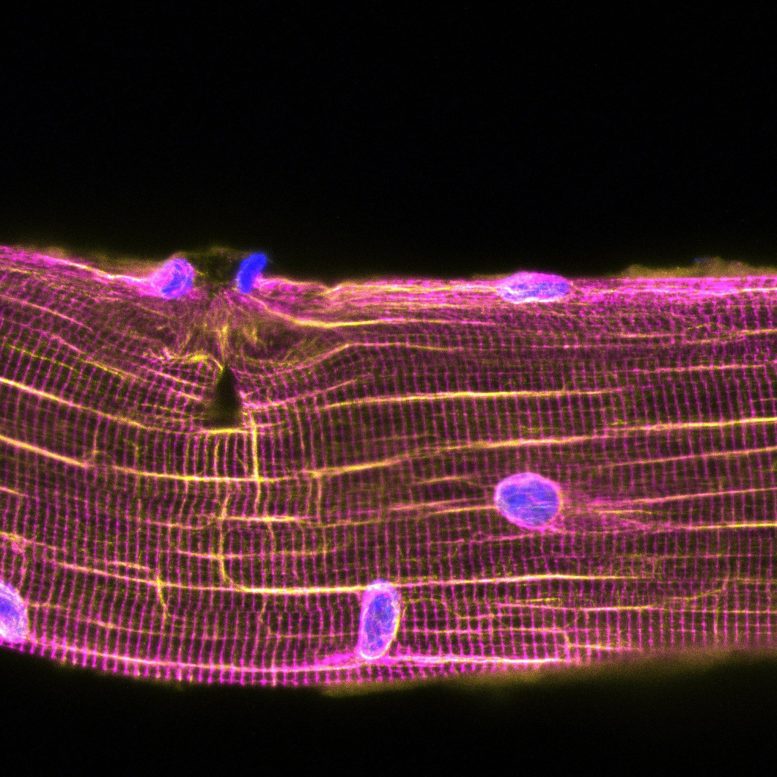
Le réseau de microtubules (vert) se réorganise au niveau de la lésion musculaire et attire les myonoyaux. Crédit : William Roman, iMM
Le muscle est connu pour se régénérer grâce à un processus complexe qui implique plusieurs étapes et dépend des cellules souches. Maintenant, une nouvelle étude menée par des chercheurs de l’Instituto de Medicina Molecular João Lobo Antunes (iMM ; Portugal) et de l’Université Pompeu Fabra (UPF Barcelone ; Espagne) et publiée le 15 octobre 2021 dans la revue scientifique Science décrit un nouveau mécanisme de régénération musculaire après des dommages physiologiques reposant sur le réarrangement des noyaux. Ce mécanisme de protection ouvre la voie à une compréhension plus large de la réparation musculaire en physiologie et en maladie.
Le tissu musculaire squelettique, l’organe responsable de la locomotion, est formé de cellules qui ont plus d’un noyau, une caractéristique presque unique dans notre corps. Malgré la plasticité des cellules musculaires, leur contraction peut s’accompagner de lésions musculaires. William Roman, auteur principal de l’étude et chercheur à l’iMM et à l’UPF de Barcelone, explique : « Même dans des conditions physiologiques, la régénération est vitale pour que le muscle supporte le stress mécanique de la contraction, qui entraîne souvent des dommages cellulaires. Bien que la régénération musculaire ait fait l’objet d’études approfondies au cours des dernières décennies, la plupart des études étaient centrées sur les mécanismes impliquant d’autres cellules, y compris les cellules souches musculaires, qui sont nécessaires en cas de dommages musculaires importants.
“Dans cette étude, nous avons trouvé un mécanisme alternatif de régénération qui est autonome des cellules musculaires”, explique Pura Muñoz-Cánoves, chef de groupe à l’Université Pompeu Fabra et responsable de l’étude. Les chercheurs ont utilisé différentes in vitro des modèles de blessure et des modèles d’exercice chez la souris et l’homme pour observer que lors d’une blessure, les noyaux sont attirés vers le site endommagé, accélérant la réparation des unités contractiles. Ensuite, l’équipe a disséqué le mécanisme moléculaire de cette observation : « Nos expériences avec des cellules musculaires en laboratoire ont montré que le mouvement des noyaux vers les sites de blessure entraînait une livraison locale de molécules d’ARNm. Ces molécules d’ARNm sont traduites en protéines sur le site de la blessure pour agir comme des éléments constitutifs de la réparation musculaire », explique William Roman. Sur l’importance de ces découvertes, Pura Muñoz-Cánoves déclare : « Cette découverte constitue une avancée importante dans la compréhension de la biologie musculaire, de la physiologie et du dysfonctionnement musculaire.
En plus de ses implications pour la recherche sur les muscles, cette étude introduit également des concepts plus généraux pour la biologie cellulaire, tels que le mouvement nucléaire vers les sites de blessure. « L’une des choses les plus fascinantes dans ces cellules est le mouvement pendant le développement de leurs noyaux, les plus gros organites à l’intérieur de la cellule, mais les raisons pour lesquelles les noyaux se déplacent sont en grande partie inconnues. Maintenant, nous avons montré une pertinence fonctionnelle pour ce phénomène à l’âge adulte pendant la réparation et la régénération cellulaire », explique Edgar R. Gomes, chef de groupe à l’Instituto de Medicina Molecular et professeur à la Faculdade de Medicina da Universidade de Lisboa, qui a codirigé l’étude. .
Référence : « La réparation musculaire après des dommages physiologiques repose sur la migration nucléaire pour la reconstruction cellulaire » par William Roman, Helena Pinheiro, Mafalda R. Pimentel, Jessica Segalés, Luis M. Oliveira, Esther García-Domínguez, Mari Carmen Gómez-Cabrera, Antonio L. Serrano, Edgar R. Gomes et Pura Muñoz-Cánoves, 15 octobre 2021, Science.
DOI : 10.1126/science.abe5620
Le travail a été développé à l’iMM et à l’UPF de Barcelone en collaboration avec l’Université de Valence. Cette étude a été financée par l’Association Française contre les Myopathies, l’Organisation Européenne de Biologie Moléculaire, le Human Frontiers Science Program, MINECO-Espagne et le Conseil Européen de la Recherche.