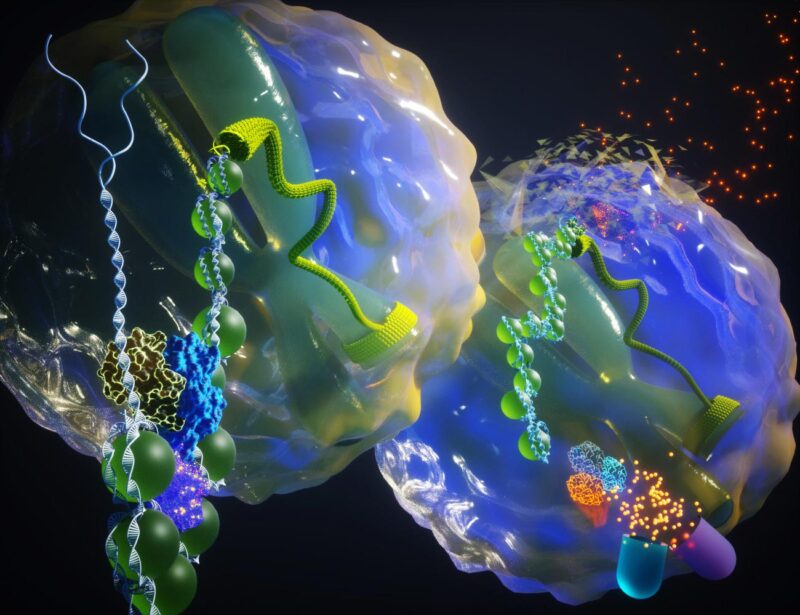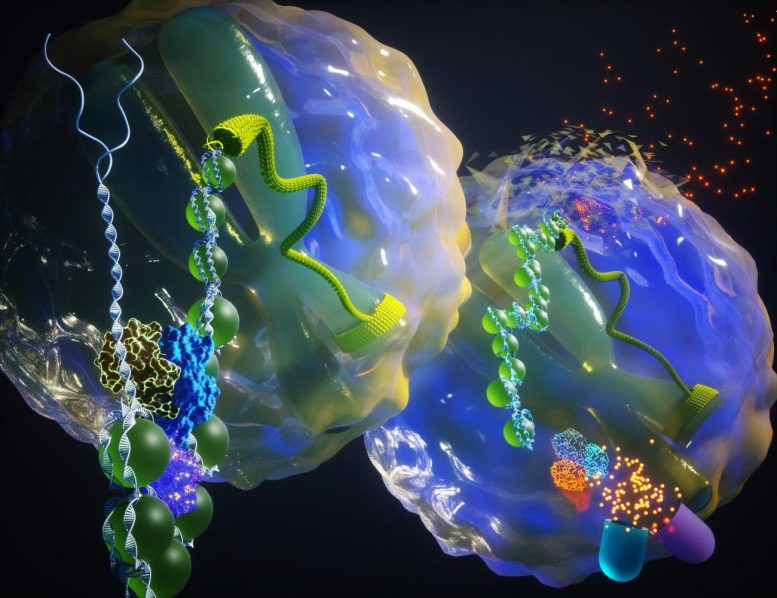
Premier plan : SWI/SNF permet la transcription oncogène. Contexte : SWI/SNF est la mise hors service inactivée de la transcription oncogène. Crédit : Ella Maru Studio
Un dégradant de la chromatine empêche les facteurs de transcription de provoquer le cancer, ce qui peut constituer une approche thérapeutique potentielle pour plus de 90 % des cancers de la prostate.
Alors que les chercheurs ont identifié plusieurs gènes responsables du cancer de la prostate, une nouvelle étude publiée dans La nature révèle le marionnettiste contrôlant les ficelles.
Les chaînes : gènes cancérigènes, ou oncogènes, tels que le récepteur aux androgènes, FOXA1, ERG et MYC.
Le marionnettiste : Un complexe de remodelage de la chromatine appelé SWI/SNF, qui contrôle la façon dont ADN est arrangé et compacté pour tenir dans le noyau d’une cellule. Une sous-unité clé de ce complexe fournit de l’énergie pour déballer l’ADN afin de donner accès à des éléments amplificateurs qui stimulent l’expression des gènes cancérigènes.
Dans la présente étude, des chercheurs de l’Université du Michigan Health Rogel Cancer Center ont démontré que le complexe SWI/SNF facilite l’accès aux activateurs auxquels les oncogènes peuvent se lier et entraîner l’expression génique en aval dans le cancer. Dégrader une sous-unité de ce complexe bloque les oncogènes, comme couper les ficelles du marionnettiste.
Cette découverte révèle une nouvelle approche du traitement des cancers de la prostate alimentée par différents facteurs génétiques, qui représentent au total plus de 90 % de tous les cancers de la prostate.
Dans les cellules humaines, l’ADN est étroitement enroulé autour des protéines histones, collectivement appelées chromatine. Ceux-ci forment une barrière physique à tous les processus basés sur l’ADN. Des machines protéiques spécialisées ont évolué qui consomment de l’énergie et modulent l’état physique de l’ADN pour son activation fonctionnelle. Ces complexes fonctionnent en étroite collaboration avec des facteurs régulateurs de liaison à l’ADN appelés facteurs de transcription pour conférer une identité et une fonction cellulaires distinctes.
« Il s’agit de la première démonstration dans le domaine du cancer que le blocage de l’accès à la chromatine peut être poursuivi comme une voie pour traiter le cancer. En compactant la chromatine autour de ces éléments amplificateurs, les facteurs de transcription sont empêchés de se lier aux éléments amplificateurs qui entraînent le cancer », a déclaré l’auteur de l’étude Arul M. Chinnaiyan, MD, Ph.D., directeur du Michigan Center for Translational Pathology et SP Hicks. Professeur de pathologie et d’urologie à Michigan Medicine.
Les chercheurs ont examiné plusieurs modèles de cancer de la prostate qui exprimaient différents oncogènes. Ils ont découvert que le blocage du complexe SWI/SNF ralentissait la croissance des cellules cancéreuses et induisait la mort cellulaire, en particulier dans les tumeurs induites par le FOXA1 ou le récepteur des androgènes. Il n’y avait aucun effet sur les cellules bénignes de la prostate.
Dans le développement normal, le complexe SWI/SNF est essentiel. « Les cellules normales peuvent survivre avec des niveaux de transcription génique par défaut, mais les cellules cancéreuses sont particulièrement dépendantes de ces régions amplificatrices. Ils ont besoin d’accéder à ces activateurs pour augmenter l’expression de cibles oncogènes », a déclaré Chinnaiyan.
Les composants du complexe SWI/SNF sont mutés dans un certain nombre de cancers, mais rarement dans le cancer de la prostate. Les cancers de la prostate induits par le récepteur des androgènes ou FOXA1 étaient plus sensibles à un dégradant SWI/SNF que même les cancers dans lesquels les sous-unités étaient mutées.
“Sans avoir de mutations, et avec seulement des facteurs de transcription oncogènes impliqués, les cellules cancéreuses de la prostate étaient extrêmement sensibles à ce dégradant, encore plus que le cancer du poumon où un composant de la voie a été muté”, a déclaré Chinnaiyan. « En désactivant ce complexe SWI/SNF, nous avons constaté une activité préférentielle contre certains cancers et aucune toxicité dans les cellules normales ou les tissus normaux. Cela est de bon augure pour les études cliniques utilisant des composés qui ciblent cette voie. »
Il suggère également la possibilité d’utiliser cette approche pour d’autres types de cancer qui sont dépendants de facteurs de transcription oncogènes, y compris certains myélomes multiples et autres cancers du sang.

Le laboratoire Chinnaiyan. Crédit : Centre de cancérologie Rogel
Les chercheurs ont utilisé un dégradeur SWI/SNF en cours de développement par la société indienne Aurigene Discovery Technologies. Ces composés sont en cours de développement pour de futurs essais cliniques.
L’équipe Rogel continuera à étudier la biologie de ce complexe, aidera à développer des composés qui ciblent ce complexe et évaluera quels autres types de cancer pourraient répondre à cette approche. Pour le cancer de la prostate, ils explorent en laboratoire une thérapie combinée utilisant le dégradeur SWI/SNF avec une thérapie anti-androgène. Cette approche n’est pas encore dans les essais cliniques.
Référence : « Cibler les ATPases SWI / SNF dans le cancer de la prostate dépendant d’un activateur » par Lanbo Xiao, Abhijit Parolia, Yuanyuan Qiao, Pushpinder Bawa, Sanjana Eyunni, Rahul Mannan, Sandra E. Carson, Yu Chang, Xiaoju Wang, Yuping Zhang, Josh N Vo, Steven Kregel, Stephanie A. Simko, Andrew D. Delekta, Mustapha Jaber, Heng Zheng, Ingrid J. Apel, Lisa McMurry, Fengyun Su, Rui Wang, Sylvia Zelenka-Wang, Sanjita Sasmal, Leena Khare, Subhendu Mukherjee, Chandrasekhar Abbineni, Kiran Aithal, Mital S. Bhakta, Jay Ghurye, Xuhong Cao, Nora M. Navone, Alexey I. Nesvizhskii, Rohit Mehra, Ulka Vaishampayan, Marco Blanchette, Yuzhuo Wang, Susanta Samajdar, Murali Ramachandra et Arul M. Chinnaiyan, 22 décembre 2021, La nature.
DOI : 10.1038 / s41586-021-04246-z
Auteurs supplémentaires : Lanbo Xiao, Abhijit Parolia, Yuanyuan Qiao, Pushpinder Bawa, Sanjana Eyunni, Rahul Mannan, Sandra E. Carson, Yu Chang, Xiaoju Wang, Yuping Zhang, Josh N. Vo, Steven Kregel, Stephanie A. Simko, Andrew D Delekta, Mustapha Jaber, Heng Zheng, Ingrid J. Apel, Lisa McMurry, Fengyun Su, Rui Wang, Sylvia Zelenka-Wang, Sanjita Sasmal, Leena Khare, Subhendu Mukherjee, Chandrasekhar Abbineni, Kiran Aithal, Mital S. Bhakta, Jay Ghurye Xuhong Cao, Nora M. Navone, Alexey I. Nesvizhskii, Rohit Mehra, Ulka Vaishampayan, Marco Blanchette, Yuzhuo Wang, Susanta Samajdar, Murali Ramachandra
Financement : Prostate Cancer Foundation Challenge Award, subventions du National Cancer Institute P50-CA186786, R35-CA231996, U01-CA214170, P30-CA046592, Programme de recherche sur le cancer de la prostate du ministère de la Défense W81XWH-21-1-0500. Chinnaiyan est chercheur au Howard Hughes Medical Institute, boursier A. Alfred Taubman et professeur à l’American Cancer Society.
Divulgation : S. Sasmal., LK, SM, CA, S. Samajdar, KA et MR sont affiliés à Aurigene Discovery Technologies. JG, MSB et MB sont affiliés à Dovetail Genomics. AMC est co-fondateur et siège aux conseils consultatifs scientifiques de LynxDx, Oncopia et Esanik. AMC siège au conseil consultatif scientifique de Tempus et Ascentage.