Crédit : Susanna Hamilton, Broad Communications
Les chercheurs ont amélioré l’efficacité de l’édition principale, une technologie d’édition de gènes hautement polyvalente basée sur CRISPR, et ont utilisé le système amélioré pour corriger les mutations de la maladie dans les cellules.
Les scientifiques ont développé une suite d’outils moléculaires qui augmentent l’efficacité d’une technique d’édition de gènes appelée édition principale pour une grande variété de types de cellules et de gènes cibles, élargissant ainsi la portée des applications thérapeutiques et de recherche de la technologie. Dans deux nouvelles études, les chercheurs ont utilisé les systèmes d’édition principaux améliorés pour corriger les mutations liées à diverses maladies neurodégénératives, métaboliques et cardiovasculaires.
D’abord décrit dans 2019, l’édition principale est une méthode précise d’édition de gènes qui a le potentiel de corriger la grande majorité des variations génétiques connues à l’origine de maladies. Les chercheurs peuvent utiliser l’édition principale pour faire ADN substitutions, insertions et suppressions sur des sites ciblés dans les cellules humaines et les animaux. L’efficacité de l’édition, cependant, varie en fonction du type de cellule en cours d’édition et de l’emplacement cible dans le génome.
Pour développer davantage la technologie, les scientifiques du Broad Institute of AVEC et Harvard a conçu une amélioration d’un composant clé du système d’édition principal appelé ARN guide d’édition principal, ou « pegRNAs », qui codent l’édition prévue et dirigent la machine d’édition principale. Dans une étude publiée récemment dans Biotechnologie naturelle, les chercheurs ont montré que les pegRNAs peuvent se dégrader dans les cellules, entraînant des pegRNAs tronqués qui interfèrent avec l’édition principale. Ils ont développé de nouveaux ARN peg qui sont protégés de la dégradation dans les cellules, augmentant largement l’efficacité de l’édition.
Dans une deuxième étude publiée récemment dans Cellule, Chercheurs larges, collaborant avec des scientifiques de université de Princeton et l’Université de Californie à San Francisco (UCSF), ont identifié les voies cellulaires qui limitent l’efficacité de l’édition principale et ont utilisé ces informations pour développer des systèmes d’édition principale de nouvelle génération.
Les chercheurs des deux études ont démontré que les nouveaux systèmes pouvaient modifier plus efficacement les mutations associées à Alzheimer maladies, maladies cardiaques, drépanocytose et maladies à prions, diabète de type 2 et autres maladies, tout en produisant moins de sous-produits indésirables.
“Ces efficacités améliorées d’édition et de pureté du produit apportent de nombreuses modifications d’un régime dans lequel elles pourraient être utiles comme outils de recherche à un régime dans lequel elles peuvent avoir un potentiel thérapeutique”, a déclaré David Liu, auteur principal des deux études, Richard Merkin. Professeur et directeur du Merkin Institute of Transformative Technologies in Healthcare au Broad Institute, professeur à l’Université Harvard et chercheur au Howard Hughes Medical Institute.
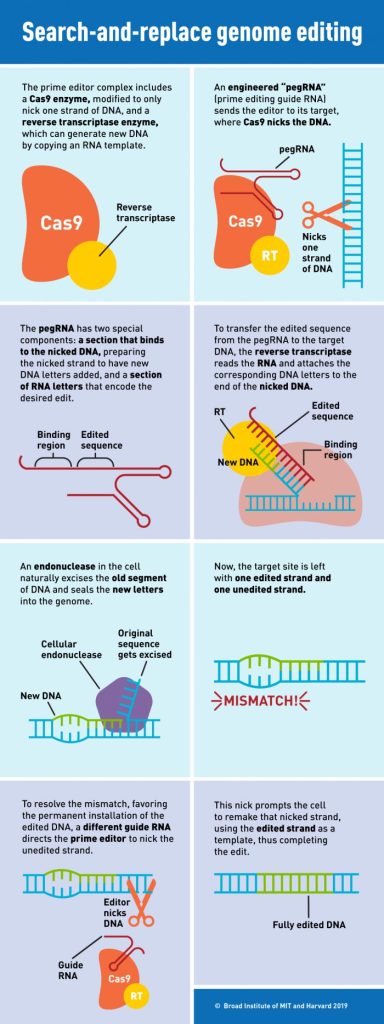
Crédit : Broad Institute
Concevoir un guide plus stable
L’édition Prime permet aux scientifiques de corriger la grande majorité des mutations pathogènes connues – y compris les substitutions, les insertions ou les suppressions de plusieurs dizaines de paires de bases – sur des sites spécifiques du génome. Contrairement à d’autres techniques d’édition du génome, l’édition principale n’implique pas de couper les deux brins d’ADN et, par conséquent, réduit les risques de résultats d’édition indésirables ou de réponses cellulaires indésirables. (Voir l’infographie ci-dessus pour en savoir plus sur le fonctionnement de l’édition principale.) Des centaines de groupes de recherche utilisent désormais l’édition principale pour étudier et corriger les mutations dans un large éventail d’organismes, notamment le riz, le blé, le poisson zèbre et les souris.
Après avoir décrit pour la première fois le premier montage en 2019, l’équipe de Liu a continué à développer la technique. Dans le Biotechnologie naturelle étude, ils ont découvert une vulnérabilité dans les pegRNAs qui a diminué l’efficacité. Ils ont découvert que la longue chaîne de ARN à la fin du pegRNA qui code l’édition était susceptible d’être dégradé par les enzymes cellulaires. Les pegRNA dégradés ne peuvent pas médier l’édition principale et également « empoisonner » le système d’édition principale en bloquant l’accès aux sites cibles par les pegRNA intacts.
Les chercheurs ont ensuite recherché des structures protectrices qu’ils pourraient ajouter aux pegRNA. Ils ont testé plusieurs séquences d’ARN différentes, identifiant des séquences qui se sont repliées dans des structures en forme de nœud qui les protègent des enzymes dégradant l’ARN. Lorsqu’ils ont modifié les pegRNA pour inclure les nœuds et une séquence de connexion, ils ont observé une augmentation substantielle de l’efficacité d’édition principale, indiquant que les nouvelles structures préservaient la matrice d’ARN pour l’édition.
En utilisant des pegRNAs, ou epegRNAs, dans une gamme de lignées cellulaires de mammifères, les chercheurs ont constaté que les epegRNAs augmentaient l’efficacité d’édition principale de trois à quatre fois en moyenne, avec de plus grandes améliorations dans les lignées cellulaires dans lesquelles l’édition principale était auparavant plus difficile.
Guider la cellule vers les éditions principales
Dans le Cellule étude, l’équipe de Liu et leurs collaborateurs ont conçu le composant protéique du système d’édition principal pour augmenter davantage l’efficacité et minimiser les sous-produits produits dans un large éventail de types de cellules, y compris les cellules de patients.
Les chercheurs ont cherché à mieux comprendre les facteurs cellulaires qui déterminent les principaux résultats d’édition afin de pouvoir concevoir des systèmes encore plus efficaces. L’équipe soupçonnait que certaines protéines cellulaires actives pendant une partie clé du processus d’édition principale – lorsque la cellule répare les molécules d’ADN créées par les éditeurs principaux – pourraient entraver ou même inverser l’édition et augmenter la production de sous-produits indésirables. Pour tester cette hypothèse, les chercheurs ont collaboré avec des équipes dirigées par Britt Adamson, professeur adjoint à l’Université de Princeton ; et Jonathan Weissman, professeur à l’UCSF au début de l’étude et maintenant professeur au MIT, membre du Whitehead Institute et chercheur au Howard Hughes Medical Institute. À l’aide d’écrans basés sur les interférences CRISPR, les équipes ont systématiquement étudié l’effet de la désactivation de chacun des 476 gènes de réparation de l’ADN différents sur l’édition principale.
Sur la base de ces résultats, les chercheurs se sont concentrés sur un processus appelé réparation des mésappariements, qui se produit naturellement dans les cellules pour corriger les mésappariements de l’ADN générés lors de la réplication et de la réparation de l’ADN. Ils ont découvert que la réparation des mésappariements interfère avec l’édition principale, diminuant l’efficacité de l’édition et augmentant la fraction d’insertions ou de suppressions involontaires.
Forte de cette idée, l’équipe a développé de nouveaux systèmes d’édition principaux, qu’ils ont appelés PE4 et PE5, qui incluent une protéine, MLH1dn, que les chercheurs ont conçue pour inhiber temporairement un composant de la réparation des mésappariements. Dans les cellules où se produit la réparation des mésappariements, les chercheurs ont découvert que PE4 et PE5 augmentaient considérablement l’efficacité d’édition et produisaient beaucoup moins de sous-produits par rapport aux systèmes d’édition principaux existants.
Enfin, les scientifiques ont créé PEmax, qui a optimisé l’architecture et l’amino acide séquence de la machinerie d’édition principale. La combinaison des améliorations des systèmes PE4 et PE5, PEmax et epegRNAs a entraîné une augmentation de 10 à 100 fois de l’efficacité d’édition par rapport aux systèmes existants.
« En combinant l’expertise de différents groupes de recherche, nous avons pu comprendre comment fonctionne l’édition principale et optimiser certaines parties du système », a déclaré Adamson. « Cette étude est un bel exemple de la façon dont la compréhension fondamentale peut orienter la conception expérimentale. »
Vers la thérapeutique
Liu dit que dans de nombreux cas, les améliorations combinées des epegRNAs et du PE4/5/max permettent aux scientifiques de créer plus facilement des modèles cellulaires de maladies, une étape critique vers le développement de thérapies.
L’équipe utilise maintenant ces systèmes pour traiter des modèles cellulaires et animaux de maladies génétiques, et continuera à sonder la biologie fondamentale de ces systèmes.
« Toutes ces innovations sont synergiques », a déclaré Liu. « Grâce à ces améliorations, nous avons pu éditer des types cellulaires importants avec une efficacité et une propreté qui pourraient un jour aider les patients souffrant de maladies à composante génétique. Ces résultats suggèrent également qu’il existe d’autres stratégies qui peuvent encore améliorer l’édition principale. »
Les références:
« Systèmes d’édition améliorés en manipulant les déterminants cellulaires des résultats d’édition » par Peter J. Chen, Jeffrey A. Hussmann, Jun Yan, Friederike Knipping, Purnima Ravisankar, Pin-Fang Chen, Cidi Chen, James W. Nelson, Gregory A. Newby , Mustafa Sahin, Mark J. Osborn, Jonathan S. Weissman, Britt Adamson et David R. Liu, 14 octobre 2021, Cellule.
DOI : 10.1016/j.cell.2021.09.018
« Les pegRNA conçus améliorent l’efficacité de l’édition principale » par James W. Nelson, Peyton B. Randolph, Simon P. Shen, Kelcee A. Everette, Peter J. Chen, Andrew V. Anzalone, Meirui An, Gregory A. Newby, Jonathan C. Chen, Alvin Hsu et David R. Liu, 4 octobre 2021, Biotechnologie naturelle.
DOI : 10.1038 / s41587-021-01039-7
Ce travail a été soutenu par le Merkin Institute of Transformative Technologies in Healthcare, les National Institutes of Health, le Howard Hughes Medical Institute, la Fondation Loulou et la Fondation Bill & Melinda Gates.