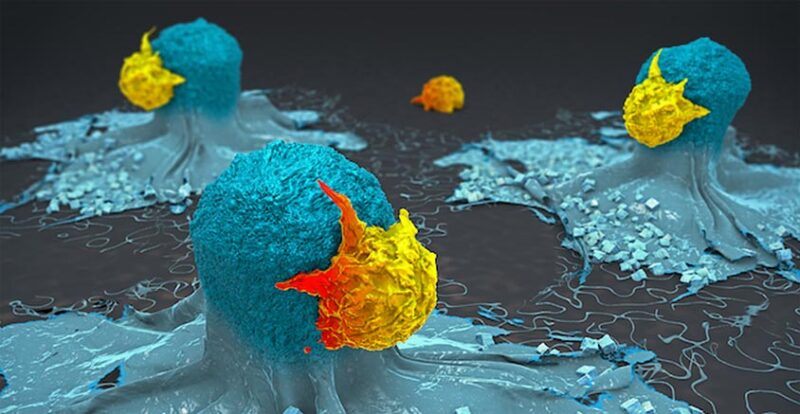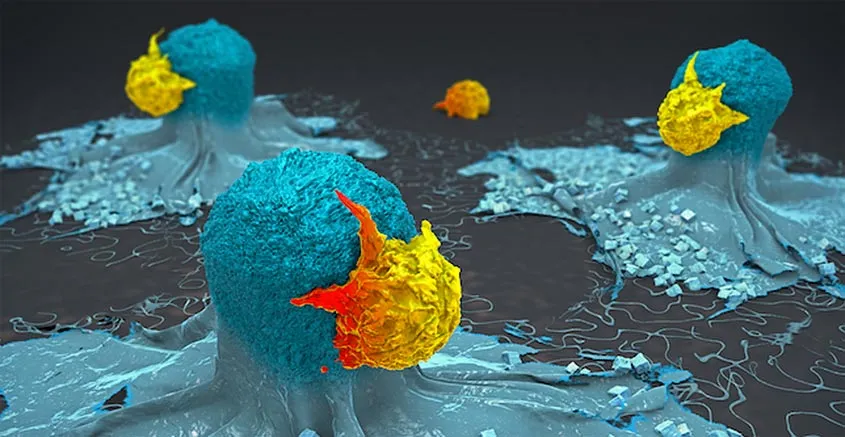
Représentation en 3D de cellules T attaquant des cellules cancéreuses. Crédit : Institut d’immunologie de La Jolla.
Des chercheurs découvrent une nouvelle stratégie pour éviter les effets secondaires de l’immunothérapie du cancer.
Il est rare qu’un essai clinique raté débouche sur une percée scientifique.
Lorsque des patients britanniques ont commencé à ressentir des effets secondaires négatifs au cours d’un essai d’immunothérapie anticancéreuse, des chercheurs du Centre d’immunothérapie anticancéreuse de l’Institut d’immunologie de La Jolla (LJI) et de l’Université de Liverpool sont revenus en arrière, ont examiné les données et travaillé avec des échantillons de patients pour déterminer ce qui n’allait pas.
Leurs conclusions, publiées aujourd’hui (4 mai 2022) dans le journal Naturefournissent des indices essentiels sur la raison pour laquelle de nombreuses immunothérapies déclenchent des effets secondaires dangereux – et laissent entrevoir une stratégie plus efficace pour traiter les patients atteints de tumeurs solides.
“Ces travaux montrent l’importance de tirer des enseignements des essais cliniques précoces “, déclare le professeur Pandurangan Vijayanand, M.D., Ph.D., de l’Institut d’immunologie de La Jolla (IILJ), qui a codirigé la nouvelle recherche avec Christian H. Ottensmeier, M.D., Ph.D., FRCP, professeur à l’Université de Liverpool, au Clatterbridge Cancer Centre NHS Foundation Trust et professeur adjoint à l’IILJ.
Succès limité des immunothérapies
Vijayanand et Ottensmeier sont tous deux des médecins scientifiques, et Ottensmeier est un oncologue traitant des patients atteints de tumeurs solides. Au cours de la dernière décennie, il a vu de plus en plus de patients prospérer grâce aux progrès des immunothérapies, qui agissent sur le système immunitaire pour tuer les cancers.
“Dans le monde de l’oncologie, l’immunothérapie a révolutionné la façon dont nous envisageons le traitement”, déclare M. Ottensmeier. “Nous pouvons administrer des immunothérapies à des patients, même si leur maladie est métastatique et se propage, puis, trois ans plus tard, leur dire au revoir et leur annoncer que leur cancer est guéri. C’est un changement stupéfiant”.
Malheureusement, seuls 20 à 30 % des patients atteints d’un cancer solide qui reçoivent des immunothérapies obtiennent une rémission à long terme. Certaines personnes ne voient aucun changement après l’immunothérapie, mais d’autres développent de graves problèmes au niveau des poumons, des intestins et même de la peau pendant le traitement. Ces effets secondaires peuvent être débilitants, voire mortels, et ces patients sont contraints d’arrêter de recevoir l’immunothérapie.
Leçons importantes d’un essai clinique
Les chercheurs de l’INL et de l’Université de Liverpool ont travaillé sur des échantillons provenant d’un récent essai clinique mené au Royaume-Uni sur des patients atteints de cancers de la tête et du cou. Les patients ont reçu une immunothérapie anticancéreuse orale appelée inhibiteur de PI3Kd. À l’époque, les inhibiteurs de PI3Kd s’étaient révélés efficaces pour les lymphomes à cellules B mais n’avaient pas encore été testés sur des tumeurs solides.
Les inhibiteurs de PI3Kd sont nouveaux sur la scène de l’immunothérapie du cancer, mais ils sont prometteurs pour leur capacité à inhiber les cellules T “régulatrices” (Tregs). Les Tregs essaient normalement d’empêcher d’autres cellules T, appelées cellules T effectrices, de cibler les propres tissus de l’organisme. Les oncologues inhibent les Tregs à l’intérieur des tumeurs afin que les cellules T effectrices puissent se libérer et générer des cellules T CD8+ tueuses de cancer.
“Le fait de disposer d’un comprimé oral capable de lever les freins – les Tregs – peut être un grand atout pour les oncologues”, déclare Vijayanand.
Malheureusement, 12 des 21 patients de l’essai ont dû interrompre le traitement prématurément parce qu’ils ont développé une inflammation dans le côlon, une condition appelée colite. “Nous pensions que ce médicament ne serait pas toxique, alors pourquoi cela se produisait-il ?”, dit Vijayanand.
L’instructeur de l’IJL Simon Eschweiler, Ph.D., a été le fer de lance de l’effort visant à revenir en arrière et à voir exactement comment le traitement par l’inhibiteur PI3Kd affectait les cellules immunitaires chez ces patients. En utilisant le séquençage génomique d’une seule cellule, il a montré que l’inhibiteur PI3Kd, en augmentant les cellules T combattant les tumeurs dans les tumeurs, a également empêché un sous-ensemble spécifique de cellules Treg de protéger le côlon. Sans les Tregs, les cellules T pathogènes, appelées cellules Th17 et Tc17, se sont installées et ont provoqué une inflammation et une colite.
Il était clair que les patients de l’essai de cancer avaient reçu une dose d’inhibiteur de PI3Kd supérieure à celle dont ils avaient besoin et que l’immunothérapie avait déséquilibré la composition délicate des cellules immunitaires dans l’intestin.
La voie qui conduit à la toxicité observée dans la nouvelle étude peut être largement applicable à d’autres organes abritant des cellules Treg similaires, et à d’autres immunothérapies ciblant les cellules Treg comme les anti-CTLA-4, dit Eschweiler.
Une nouvelle stratégie de dosage pourrait sauver des vies
L’équipe a découvert que l’administration de doses intermittentes pourrait être une stratégie de traitement valable qui combine une immunité anti-tumorale soutenue et une toxicité réduite.
Le siteLes chercheurs conçoivent actuellement un essai clinique sur l’homme pour tester la stratégie de dosage intermittent chez l’homme.
“Cette recherche illustre la façon dont on peut passer d’une étude clinique à une étude sur des souris pour voir ce qui se cache derrière la toxicité chez ces patients”, déclare le professeur et directeur scientifique de l’IJL Mitchell Kronenberg, Ph.D., dont le laboratoire a dirigé une grande partie du travail sur le modèle de souris pour la nouvelle étude.
Comment expliquer le manque de toxicité dans les essais sur les lymphomes à cellules B ? Eschweiler explique que les patients atteints de lymphome dans les études précédentes avaient reçu plusieurs thérapies antérieures, ce qui avait entraîné un état d’immunodépression général. Cela signifie que les patients atteints de lymphome n’ont pas eu le même type – ou la même ampleur – de réponse immunitaire lors de l’inhibition de PI3Kd. En revanche, les patients atteints de cancer de la tête et du cou n’ont jamais été traités. Leur système immunitaire n’étant pas compromis, les effets indésirables liés au système immunitaire étaient à la fois plus rapides et plus prononcés.
Dans l’ensemble, la nouvelle étude montre l’importance d’étudier non seulement les thérapies personnalisées, mais aussi les doses et les calendriers de traitement personnalisés.
Comme l’explique Ottensmeier, il y a dix ans, les médecins n’avaient qu’un seul type d’immunothérapie à proposer. Soit elle aidait le patient, soit elle ne l’aidait pas. Aujourd’hui, les médecins disposent d’une bibliothèque d’immunothérapies qui s’enrichit rapidement et parmi lesquelles ils peuvent choisir.
Vijayanand et Ottensmeier sont parmi les premiers chercheurs à utiliser des outils de séquençage génomique unicellulaire pour déterminer les combinaisons thérapeutiques les plus efficaces pour chaque patient, ainsi que le meilleur moment pour administrer ces thérapies. Dans une étude de 2021 Nature Immunology étudeles deux chercheurs ont montré l’importance potentielle de l’administration d’immunothérapies dans un ordre spécifique.
“Si vous concevez bien vos essais cliniques et appliquez une génomique sophistiquée, vous avez beaucoup à apprendre”, dit Vijayanand. “Vous pouvez comprendre ce qui se passe et revenir vers les patients”.
Leur mission ne serait pas possible sans une équipe internationale de collaborateurs hautement qualifiés. “Cette étude a été un effort de collaboration extraordinaire”, dit Ottensmeier. “Il a fallu des groupes d’oncologues médicaux, de chirurgiens, d’infirmières de recherche, nos patients et des scientifiques – tous travaillant ensemble des deux côtés de l’étang.”
Référence : “Intermittent PI3Kδ inhibition sustains anti-tumor immunity and curbs irAEs” par Simon Eschweiler, Ciro Ramírez-Suástegui, Yingcong Li, Emma King, Lindsey Chudley, Jaya Thomas, Oliver Wood, Adrian von Witzleben, Danielle Jeffrey, Katy McCann, Hayley Simon, Monalisa Mondal, Alice Wang, Martina Dicker, Elena Lopez-Guadamillas, Ting-Fang Chou, Nicola A. Dobbs, Louisa Essame, Gary Acton, Fiona Kelly, Gavin Halbert, Joseph J. Sacco, Andrew Graeme Schache, Richard Shaw, James Anthony McCaul, Claire Paterson, Joseph H. Davies, Peter A. Brennan, Rabindra P. Singh, Paul M. Loadman, William Wilson, Allan Hackshaw, Gregory Seumois, Klaus Okkenhaug, Gareth J. Thomas, Terry M. Jones, Ferhat Ay, Greg Friberg, Mitchell Kronenberg, Bart Vanhaesebroeck, Pandurangan Vijayanand et Christian H. Ottensmeier, 4 mai 2022, Nature.
DOI: 10.1038/s41586-022-04685-2
Les auteurs supplémentaires de l’étude, “Intermittent PI3Kδ inhibition sustains anti-tumor immunity and curbs irAEs,” comprennent Ciro Ramírez-Suástegui, Yingcong Li, Emma King, Lindsey Chudley, Jaya Thomas, Oliver Wood, Adrian von Witzleben, Danielle Jeffrey, Katy McCann, Hayley Simon, Monalisa Mondal, Alice Wang, Martina Dicker, Elena Lopez-Guadamillas, Ting-Fang Chou, Nicola A Dobbs, Louisa Essame, Gary Acton, Fiona Kelly, Gavin Halbert, Joseph J Sacco, Andrew Graeme Schache, Richard Shaw, James Anthony McCaul, Claire Paterson, Joseph H. Davies, Peter A Brennan, Rabindra P Singh, Paul Loadman, William Wilson, Allan Hackshaw, Gregory Seumois, Klaus Okkenhaug, Gareth J. Thomas, Terry M. Jones, Ferhat Ay, Greg Friberg, et Bart Vanhaesebroeck.
Cette recherche a été soutenue par la subvention d’essai CDD CRUKD/15/004 (CI : CHO), un Cancer Research UK Centres Network Accelerator Award Grant (A21998), le CRUK et NIHR Experimental Cancer Medicine Center (ECMC) Southampton (A15581), le CRUK et NIHR ECMC Liverpool (A25153), Cancer Research UK Programme Grant (C23338/A25722) ; le centre de recherche biomédicale NIHR UCLH du Royaume-Uni, S10OD025052 (Illumina Novaseq6000), S10RR027366 (trieur de cellules FACSAria II), subvention NIH P01 DK46763, la fondation William K. Bowes Jr Foundation, et Whittaker iCure Foundation, la bourse de recherche DFG Deutsche Forschungsgemeinschaft # WI 5255/1-1:1, bourse Erwin Schrödinger (M.D.). La réalisation clinique de ce travail a été soutenue par le Wessex Clinical Research Network et le National Institute of Health Research UK. Les chercheurs remercient Cancer Research UK (Centre for Drug Development) pour le parrainage de l’essai clinique et pour le financement et la gestion.de l’essai clinique de phase II, ainsi qu’à Amgen pour la fourniture du PI3Kdi AMG319.