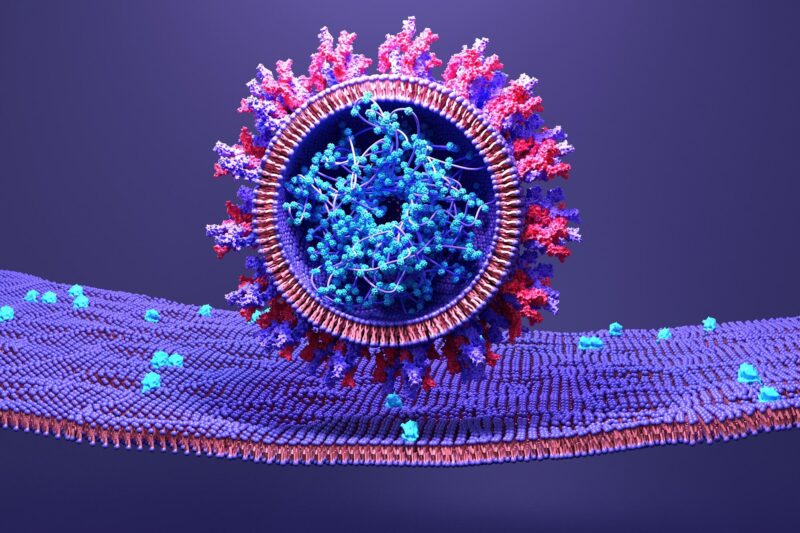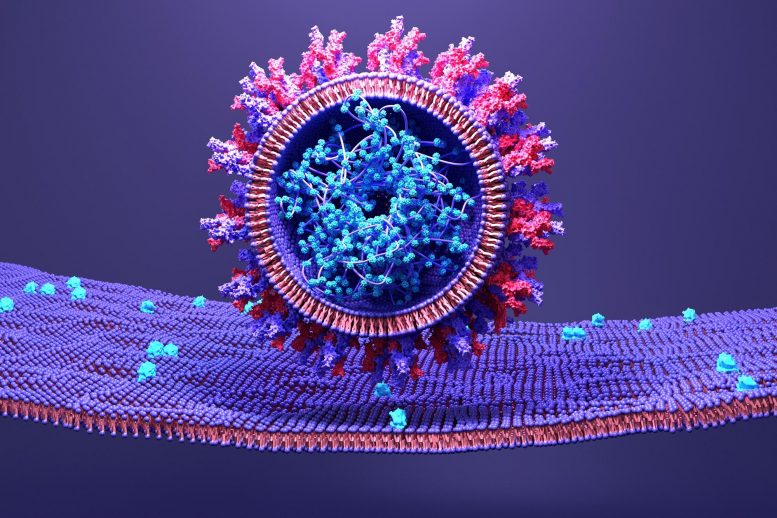
Le SRAS-CoV-2 utilise sa protéine de surtension pour s’attacher à une cellule hôte.
Un modèle structurel de la SRAS-CoV-2 les protéines de pointe alors que le virus se combine avec les cellules individuelles de l’hôte révèle une chance de perturber la dynamique et d’arrêter la transmission.
Selon une étude publiée le 31 août 2021, les scientifiques ont simulé le changement de la structure de la protéine de surtension du SRAS-CoV-2 lorsqu’elle reconnaît la cellule hôte particulière afin de la rendre accessible. eLife .
La recherche implique qu’une structure autorisée par les substances sucrées sur les protéines de pointe pourrait être essentielle pour l’entrée cellulaire et que perturber cette structure est en fait une stratégie pour arrêter la transmission de la maladie.
Un aspect important du cycle de vie du SRAS-CoV-2 est sa capacité à se fixer au tissu hôte et à transférer le matériel génétique. Cela se fait via ses protéines de pointe, qui sont composées de 3 composants distincts – un forfait transmembranaire qui ancre la pointe particulière au virus informatique et deux sous-unités Ersus (S1 plus S2) à l’extérieur du virus. Pour envahir une cellule humaine, la sous-unité S1 se lie à une particule à la surface des cellules individuelles appelée ACE2, et la sous-unité S2 se détache et combine les parois cellulaires virales et humaines. Bien que ce processus soit bien connu, l’ordre exact dans lequel il se produit n’est pas encore vraiment découvert. Cependant, la compréhension des mouvements à l’échelle de la microseconde et au niveau atomique de telles structures protéiques peut révéler des objectifs potentiels pour COVID-19[feminine traitement.
« La plupart des traitements et vaccins actuels contre le SRAS-CoV-2 se sont concentrés sur le stade particulier de reconnaissance ACE2 de l’attaque virale, mais une technique alternative consiste à cibler le changement structurel particulier qui permet au virus de se fondre dans la cellule hôte Web humaine. » clarifie le co-auteur de l’étude José N. Onuchic, Harry C et Olga K Wiess, professeur de physique à l’Université Rice, Houston, États-Unis, et codirecteur du Centre destiné à la physique biologique théorique. “Mais sonder expérimentalement ces types de bâtiments intermédiaires et transitoires est extrêmement difficile, et nous avons donc utilisé une simulation informatique suffisamment simplifiée pour étudier ce grand système particulier tout en conservant des détails physiques adéquats afin de capturer les caractéristiques de la sous-unité S2 lors de sa transition dans entre les formes pré-fusion et post-fusion. ”
L’équipe s’était particulièrement intéressée au rôle particulier des molécules de glucose sur la protéine de surtension, appelées glycanes. Pour voir si le nombre, le type et la position des glycanes jouent ou non un rôle dans l’étape de fusion de la couche membranaire associée à l’accès aux cellules virales en médiant ces types de formations de pointes intermédiaires, ils ont effectué un grand nombre de simulations en utilisant un tout- atome conception basée sur la structure. De tels modèles vous permettent de prédire le vol des atomes dans le temps en tenant compte des causes stériques, c’est-à-dire de l’impact exact des atomes voisins sur le mouvement des autres.
Les simulations ont découvert que les glycanes forment une «cage» qui emprisonne la «tête» de la sous-unité S2, provoquant une pause sous une forme avancée entre afin de se détacher de la sous-unité S1 et lorsque les membranes virales et cellulaires sont jointes. . Lorsque les glycanes ne sont pas là, la sous-unité S2 passe beaucoup moins de temps dans cette conformation.
Les simulations suggèrent également que le fait de garder l’esprit S2 dans un emplacement particulier aide la sous-unité S2 à recruter des cellules hôtes individuelles et à fusionner avec leurs parois, en permettant de reconnaître de courtes protéines saines appelées peptides de fusion du virus. Certes, la glycosylation de S2 a significativement augmenté le risque qu’un peptide de fusion s’étende vers la couche membranaire de la cellule hôte, alors que lorsque les glycanes étaient absents, il n’y a qu’une probabilité marginale que cela se produise.
« Nos simulations indiquent que les glycanes peuvent induire la pause pendant la transition protéique de montée subite. Cela donne une opportunité cruciale pour les peptides de fusion particuliers afin de capturer la cellule sponsor », prouve le co-auteur Paul D. Whitford, enseignant associé au Center for Theoretical Biological Physics et au département associé à la physique, Northeastern University ou collège, Boston. , NOUS. « En l’absence de glycanes, la particule virale échouerait probablement chez votre hôte. Notre recherche révèle comment le sucre peut contrôler l’infectiosité et fournit une base pour vérifier expérimentalement les facteurs qui ont un impact sur la dynamique de l’agent pathogène envahissant et mortel. ”
Référence : « Les réarrangements stériquement limités de la protéine SARS-CoV-2 Spike managent l’invasion cellulaire » simplement par Esteban Dodero-Rojas, Jose N Onuchic et Paul Charles Whitford, 31 août 2021, eLife .
DOI : 10. 7554 / eLife. 70362