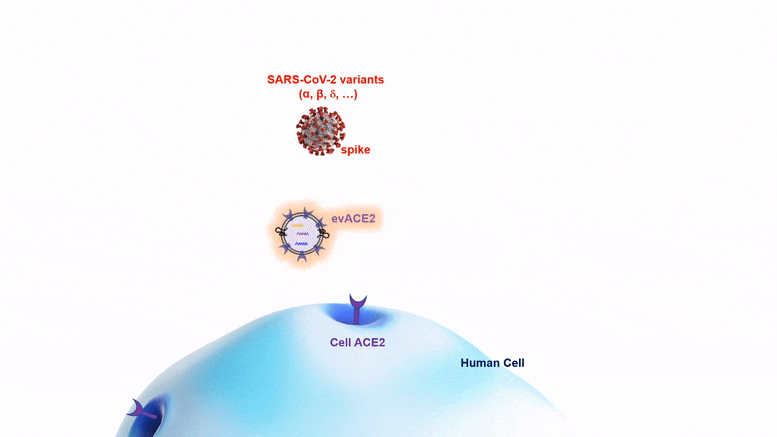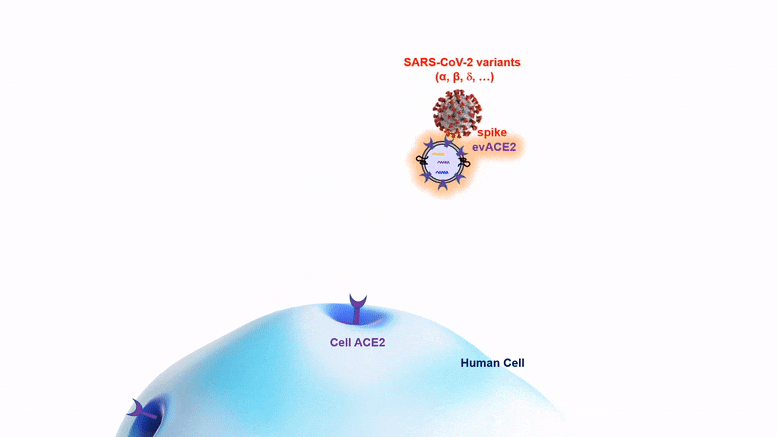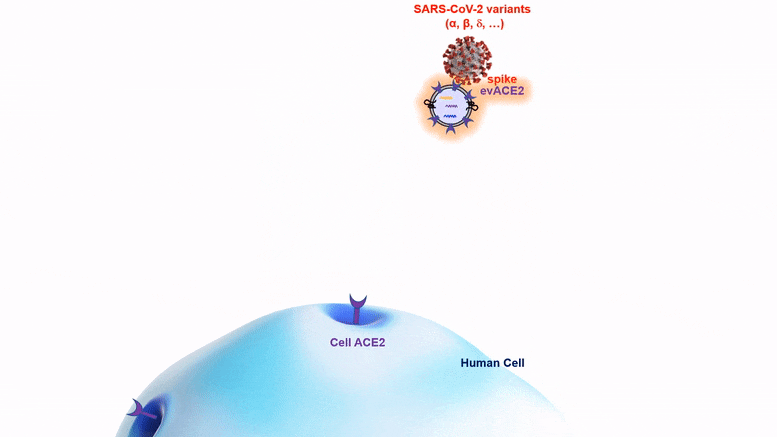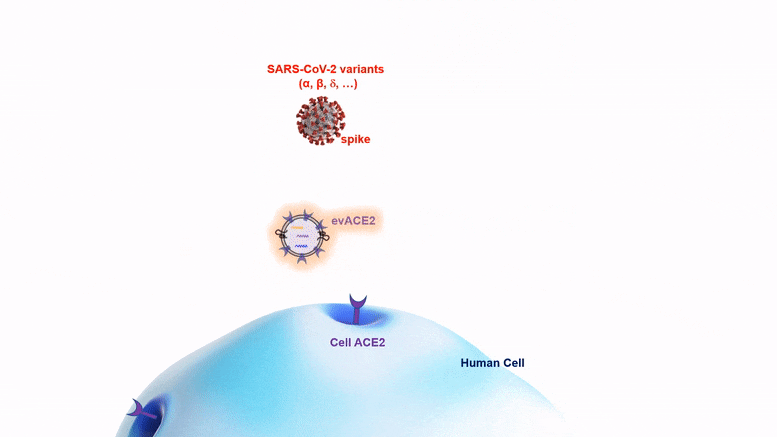
La nano-bulle evACE2, qui pourrait être administrée par pulvérisation nasale, combat les nouvelles variantes du COVID aussi bien, voire mieux, que la souche originale du virus SRAS-CoV-2.
La nano-bulle evACE2 combat les nouveaux variants aussi bien ou mieux que la souche originale du virus.
- Un médicament peut être administré sous forme de spray nasal
- Agit comme un leurre pour capturer le virus avant qu’il ne pénètre dans la cellule.
- Il est urgent d’identifier de nouvelles thérapies”.
- EvACE2 apparaît naturellement dans COVID-19 dans le cadre de la réponse antivirale
Des scientifiques du Northwestern Medicine et du MD Anderson Cancer Center de l’Université du Texas ont identifié des nanobulles naturelles contenant la protéine ACE2 (evACE2) dans le sang des patients atteints de la maladie COVID-19 et ont découvert que ces particules de taille nanométrique pouvaient bloquer l’infection par de larges souches de virus. SRAS-CoV-2 dans des études précliniques.
L’evACE2 agit comme un leurre dans l’organisme et peut servir de produit thérapeutique à développer pour la prévention et le traitement des souches actuelles et futures du SRAS-CoV-2 et des futurs coronavirus, ont déclaré les scientifiques. Une fois développé en tant que produit thérapeutique, il pourra bénéficier aux êtres humains en tant que traitement biologique avec une toxicité minimale.
L’étude est la première à montrer que les protéines evACE2 sont capables de combattre les nouvelles variantes du SRAS-CoV-2 avec une efficacité égale ou supérieure à celle du blocage de la souche originale. Les chercheurs ont découvert que ces nanobulles evACE2 existent dans le sang humain en tant que réponse antivirale naturelle. Plus la maladie est grave, plus les niveaux d’evACE2 détectés dans le sang du patient sont élevés.
L’article sera publié dans Nature Communications aujourd’hui (20 janvier 2022).
“Chaque fois qu’une nouvelle souche mutante du SRAS-CoV-2 fait son apparition, le vaccin original et les anticorps thérapeutiques peuvent perdre de leur efficacité contre les variantes alpha, bêta, delta et la plus récente variante omicron”, a déclaré le Dr Huiping Liu, coauteur de l’étude et professeur associé de pharmacologie et de médecine à l’Université d’Oxford. Northwestern University Feinberg School of Medicine et médecin à la Northwestern Medicine. “Cependant, la beauté d’evACE2 est sa superpuissance à bloquer de larges souches de coronavirus, y compris l’actuel SRAS-CoV-2 et même les futurs coronavirus du SRAS, pour les empêcher d’infecter les humains.”
“Nos études sur les souris démontrent le potentiel thérapeutique d’evACE2 pour prévenir ou bloquer l’infection par le SRAS-CoV-2 lorsqu’il est délivré dans les voies respiratoires par des gouttelettes”, a déclaré Liu.
Les protéines evACE2 sont de minuscules bulles lipidiques (graisse) de la taille d’une nanoparticule qui expriment la protéine ACE2, comme des poignées auxquelles le virus peut s’accrocher. Ces bulles agissent comme des leurres pour attirer le virus du SRAS-CoV-2 loin de la protéine ACE2 sur les cellules, et c’est ainsi que le virus infecte les cellules. La protéine de pointe du virus s’accroche à la poignée de l’evACE2 au lieu de l’ACE2 cellulaire, ce qui l’empêche de pénétrer dans la cellule. Une fois capturé, le virus va soit flotter sans danger autour de la cellule, soit être éliminé par une cellule immunitaire macrophage. À ce stade, il ne peut plus causer d’infection.
“La principale conclusion de cette étude est l’identification de vésicules extracellulaires naturelles dans l’organisme qui expriment le récepteur ACE2 à leur surface et qui font partie de la défense adaptative normale contre les virus responsables du COVID-19”, a déclaré le Dr Raghu Kalluri, coauteur principal et président du département de biologie du cancer à MD Anderson. “En nous appuyant sur ces résultats, nous avons découvert un moyen d’exploiter cette défense naturelle comme une nouvelle thérapie potentielle contre ce virus dévastateur.”
La pandémie de COVID-19 a été prolongée et mise au défi par un virus en constante évolution, le SARS-CoV-2. L’un des plus grands défis est la cible mobile du coronavirus pathogène qui évolue constamment vers de nouvelles souches virales (variantes) avec des mutations. Ces nouvelles souches virales abritent diverses modifications de la protéine de pointe virale avec des taux d’infection élevés et une augmentation des percées dues à l’inefficacité des vaccins et à la résistance aux anticorps monoclonaux thérapeutiques.
“Il reste urgent d’identifier de nouvelles thérapies”, a déclaré M. Liu. ” Nous pensons que evACE2 peut relever les défis et lutter contre les larges souches de SRAS-CoV-2 et les futurs coronavirus émergents afin de protéger les personnes immunodéprimées (au moins 2,7 % des adultes américains), non vaccinées (94 % dans les pays à faible revenu et plus de 30 % aux États-Unis) et même vaccinées contre les infections percées.
Northwestern et MD Anderson ont déposé un brevet sur evACE2. L’objectif est de collaborer avec des partenaires industriels et de développer evACE2 en tant que produit thérapeutique biologique (spray nasal ou injection).thérapeutique) pour la prévention et le traitement du COVID-19. Liu et un autre coauteur principal, Deyu Fang, de l’unité de pathologie de Northwestern, ont créé une nouvelle société, Exomira, pour exploiter ce brevet et développer evACE2 en tant que thérapie.
Référence : “Des vésicules extracellulaires circulantes exprimant l’ACE2 bloquent de larges souches de SARS-CoV-2” 20 janvier 2022, Nature Communications.
DOI: 10.1038/s41467-021-27893-2
Une équipe de plus de 30 auteurs a collaboré à ce travail. Parmi eux, quatre coauteurs principaux : Lamiaa El-Shennawy, Andrew Hoffmann et Nurmaa Dashzeveg, tous du laboratoire Liu de Northwestern, et Kathleen McAndrews du laboratoire Raghu Kalluri de MD Anderson. Plusieurs coauteurs principaux ont contribué de manière significative à la publication, notamment leurs collègues de Northwestern, les docteurs Michael Ison (maladies infectieuses), Yuan Luo (médecine préventive), Alexis Demonbreun (pharmacologie) et Daniel Batle (néphrologie et hypertension), ainsi que les docteurs Dominique Missiakas et Glenn Randall, à l’Université d’Oxford. Université de Chicago Howard T. Ricketts Laboratory et Tujin Shi au Pacific Northwest National Laboratory.
La collaboration entre Northwestern et M.D. Anderson a été encouragée par la co-auteure Valerie LeBleu, étudiante en MD/MBA à l’école de gestion Feinberg et Kellogg et anciennement professeur adjoint de biologie du cancer à MD Anderson.
Ce travail a été soutenu par le Chicago Biomedical Consortium Accelerator Award ; le Northwestern University Feinberg School of Medicine Emerging and Re-emerging Pathogens Program ; le National Cancer Institute, le Blood Biobank fund ; et Lyda Hill Philanthropies. Les départements de pharmacologie et de pathologie de l’université Northwestern, l’Institut des sciences cliniques et translationnelles de l’université Northwestern et le Robert H. Lurie Comprehensive Cancer Center de l’université Northwestern ont également contribué au financement de ces travaux.