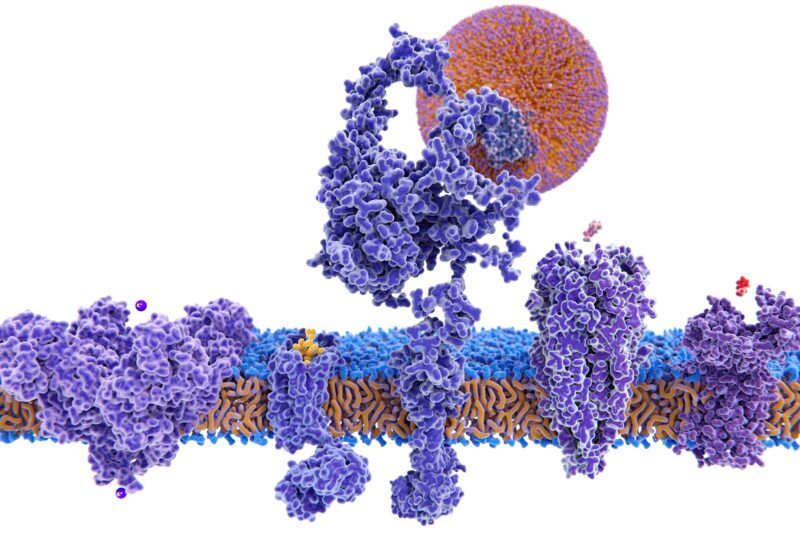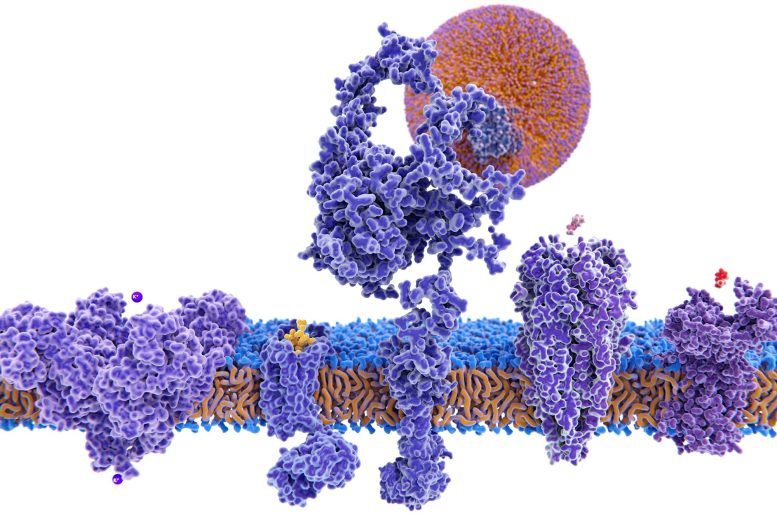
Structure d’une variété de protéines membranaires.
Des chercheurs de l’Université de Toronto ont identifié des centaines de nouvelles protéines qui pourraient jouer un rôle dans la mucoviscidose et qui pourraient expliquer pourquoi certains patients répondent mieux que d’autres aux thérapies actuelles.
Beaucoup de ces protéines – qui font partie d’un groupe de molécules médicamenteuses appelées protéines membranaires – interagissent avec la protéine CFTR, qui, lorsqu’elle est absente ou défectueuse, entraîne l’accumulation de mucus dans les poumons et d’autres organes, souvent fatale dans la fibrose kystique.
“Nous avons identifié plus de 400 protéines associées à la protéine CFTR saine ou mutante, et nous avons montré que certaines d’entre elles pouvaient prédire la variabilité des symptômes des patients et des réponses aux traitements”, a déclaré Igor Stagljar, chercheur principal de l’étude et professeur au Donnelly Centre for Cellular and Biomolecular Research de la Faculté de médecine Temerty de l’Université de Toronto.
“Grâce à une vision plus complète du réseau d’interaction des protéines CFTR, nous pouvons identifier de nouvelles cibles médicamenteuses qui devraient permettre des thérapies plus spécifiques aux patients”, a déclaré Stagljar.
Le journal Biologie des systèmes moléculaires a publié les résultats aujourd’hui (14 février 2022), et les a présentés en couverture de son numéro de février.

Le professeur Igor Stagljar. Crédit : Photo de John McGraw
Pour aider à identifier les interactions protéine-protéine impliquant CFTR, les chercheurs ont développé une nouvelle technologie basée sur une plateforme qu’ils ont conçue en 2014. L’approche est une version à haut débit de leur système Mammalian Membrane Two-Hybrid, et elle permet de cribler beaucoup plus de protéines membranaires qui s’associent à une protéine spécifique.
“La conception précédente était basée sur un réseau, et nous ne pouvions cribler qu’environ 200 protéines à la fois”, a déclaré Stagljar, qui est également professeur de biochimie et de génétique moléculaire à l’Université de Toronto. “Avec cette nouvelle technologie, nous avons introduit plusieurs changements qui nous permettent de cribler des milliers de cibles protéiques simultanément, de manière groupée.”
Stagljar et son laboratoire ont utilisé cette technologie pour trouver plusieurs protéines négligées, notamment de nombreuses protéines membranaires qui pourraient jouer un rôle dans la fonction CFTR et la fibrose kystique. Les protéines membranaires représentent environ un tiers de toutes les protéines présentes dans les cellules et environ 65 % de toutes les cibles thérapeutiques.
Un candidat particulièrement prometteur que l’équipe a trouvé est la protéine Fibrinogen-like 2, dont on pense qu’elle joue un rôle dans l’hépatite, les maladies du foie et la fonction immunitaire. L’équipe a montré que la régulation négative de cette protéine entraîne une augmentation de l’expression du CFTR dans les organoïdes – 3D. in vitro modèles qui montrent comment les cellules interagissent dans un organe, dans ce cas avec des tissus intestinaux dérivés de patients.
“Nous pensons que la protéine Fibrinogen-like 2 est une cible médicamenteuse précieuse pour la mucoviscidose, et nous travaillons maintenant avec nos collaborateurs pour valider d’autres protéines qui sont apparues dans cette étude et dans les études d’association pangénomique “, a déclaré Stagljar.
La mucoviscidose touche plus de 90 000 personnes dans le monde. La maladie peut survenir lorsque les enfants héritent de deux gènes CFTR mutés, un de chaque parent, ce qui entraîne des protéines CFTR défectueuses à la surface des cellules des poumons et d’autres organes.
Environ 2 000 mutations connues du gène CFTR peuvent causer la maladie, et les traitements médicamenteux sont souvent adaptés en fonction du profil génétique de chaque patient. Certains de ces traitements ont connu un succès remarquable au cours de la dernière décennie en rétablissant la fonction de la protéine CFTR. Mais la réponse au traitement peut varier considérablement, même chez les patients qui partagent la même mutation.
Stagljar a déclaré que si les chercheurs soupçonnent depuis longtemps que ces variations dans la réponse au traitement dépendent de modificateurs génétiques secondaires et de facteurs environnementaux, l’étude actuelle suggère fortement que les protéines qui s’associent physiquement à la protéine CFTR sont l’un de ces facteurs.
Deux membres du laboratoire de Stagljar sont les co-premiers auteurs de l’article. Le Dr SangHyun Lim, un étudiant en doctorat de biochimie au moment de l’étude qui est maintenant un chercheur postdoctoral chez Genentech, et le Dr Jamie Snider, associé de recherche principal.
Stagljar a déclaré que ces deux personnes ont joué un rôle déterminant dans la recherche, et montrent que l’université continue de former et de bénéficier de grands talents en matière de recherche. Tous deux ont travaillé en étroite collaboration avec d’autres laboratoires sur le projet, en particulier à l’Université de Toronto, à l’Hôpital pour enfants malades et à l’Université de Lisbonne au Portugal.
“Cette étude représente une percée dans le domaine de la protéomique et de la fibrose kystique, mais elle aurait été impossible sans nos nombreux collaborateurs”, a déclaré Stagljar. “Nous avons développé la technologie, maisnous ne sommes pas des experts de la mucoviscidose, de la physiologie et d’autres domaines, alors nous nous sommes associés aux meilleurs et ils ont réussi – c’est ainsi que fonctionne la science de nos jours.”
Référence : “CFTR interactome mapping using the mammalian membrane two-hybrid high-throughput screening system” par Sang Hyun Lim, Jamie Snider, Liron Birimberg-Schwartz, Wan Ip, Joana C Serralha, Hugo M Botelho, Miquéias Lopes-Pacheco, Madalena C Pinto, Mohamed Taha Moutaoufik, Mara Zilocchi, Onofrio Laselva, Mohsen Esmaeili, Max Kotlyar, Anna Lyakisheva, Priscilla Tang, Lucía López Vázquez, Indira Akula, Farzaneh Aboualizadeh, Victoria Wong, Ingrid Grozavu, Teuta Opacak-Bernardi, Zhong Yao, Meg Mendoza, Mohan Babu, Igor Jurisica, Tanja Gonska, Christine E Bear, Margarida D Amaral et Igor Stagljar, 14 février 2022, Biologie des systèmes moléculaires.
DOI : 10.15252/msb.202110629