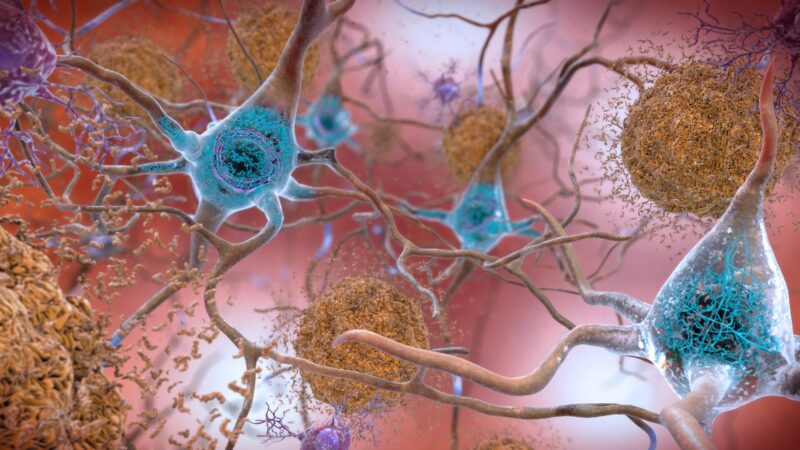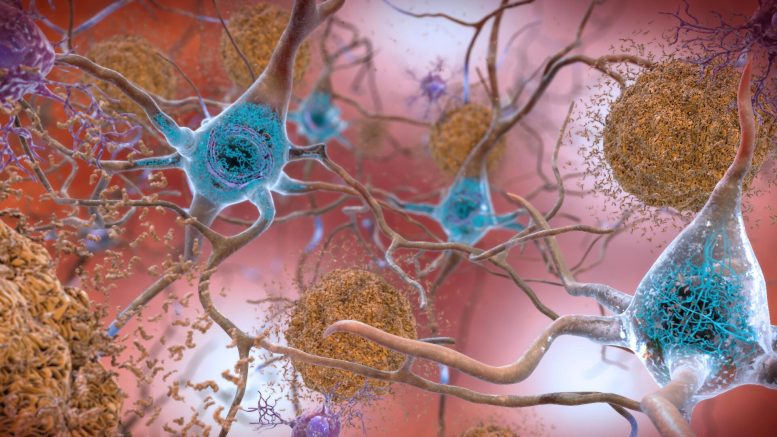
Des niveaux anormaux de protéine bêta-amyloïde dans le cerveau forment des plaques (marron dans cette illustration) entre les neurones, perturbant les cellules. La protéine Tau peut former des enchevêtrements (bleus) dans les neurones, nuisant à la communication neuronale. Crédit” National Institute on Aging, NIH
Regardez au plus profond du cerveau de quelqu’un avec Alzheimer maladie, la plupart des formes de démence ou le syndrome lié à une commotion cérébrale connu sous le nom d’encéphalopathie traumatique chronique (CTE) et vous trouverez un coupable suspecté commun : des enchevêtrements filandreux ressemblant à des boules de poils d’une protéine appelée tau.
De telles conditions, collectivement connues sous le nom de « tauopathies », frappent des dizaines de personnes à travers le monde, la maladie d’Alzheimer touchant à elle seule six millions de personnes aux États-Unis.
Mais plus d’un siècle après que le psychiatre allemand Alois Alzheimer ait découvert les enchevêtrements tau, les scientifiques ont encore beaucoup à apprendre à leur sujet.
Une étude de l’Université du Colorado à Boulder, publiée dans la revue Neurone, montre pour la première fois que les agrégats tau engloutissent ARN, ou ribonucléique acide, à l’intérieur des cellules et interfèrent avec un mécanisme intégral appelé épissage, par lequel les cellules produisent finalement les protéines nécessaires.
« Comprendre comment tau conduit à la neurodégénérescence est essentiel pour comprendre non seulement la maladie d’Alzheimer, mais également plusieurs autres maladies neurologiques », a déclaré l’auteur principal Roy Parker, professeur de biochimie et directeur du BioFrontiers Institute à CU Boulder. “Si nous pouvons comprendre ce qu’il fait et comment il va mal dans la maladie, nous pouvons développer de nouvelles thérapies pour des conditions qui sont maintenant en grande partie incurables.”
L’étude a été dirigée par Evan Lester, un candidat MD/PhD dans le programme de formation des scientifiques médicaux, qui permet aux étudiants de travailler simultanément vers un diplôme en médecine de l’Université du Colorado Anschutz Medical Campus et un doctorat de CU Boulder.
Pendant une partie de sa formation médicale, Lester a travaillé aux côtés de médecins et de patients du CU Alzheimer’s and Cognition Center à Aurora, voyant de près à quel point plus de recherche est nécessaire.
“Nous ne pouvons rien faire pour ces patients pour le moment – aucun traitement modificateur de la maladie d’Alzheimer ou de la plupart des autres tauopathies”, a déclaré Lester, notant que 70% des maladies neurodégénératives seraient au moins partiellement liées aux agrégats tau.
Pour l’étude, les chercheurs ont isolé des agrégats de tau à partir de lignées cellulaires et de cerveaux de souris atteintes d’une maladie semblable à la maladie d’Alzheimer. Ensuite, ils ont utilisé des techniques de séquençage génétique pour déterminer ce qu’il y avait à l’intérieur.
Ils ont confirmé pour la première fois que les agrégats tau contiennent de l’ARN, ou acide ribonucléique, une molécule simple brin clé pour synthétiser des protéines dans les cellules. Ils ont identifié de quel type d’ARN il s’agit, en particulier le snRNA, ou petit ARN nucléaire, et le snoRNA, ou petit ARN nucléolaire.
Ils ont également découvert que tau interagit avec des éléments de la machinerie cellulaire appelés taches nucléaires, séquestrant et déplaçant des protéines à l’intérieur et perturbant un processus appelé épissage de l’ARN dans lequel la cellule élimine le matériel inutile pour générer un nouvel ARN sain.
“Les agrégats tau semblent séquestrer l’ARN et les protéines liés à l’épissage, perturbant leur fonction normale et altérant la capacité de la cellule à fabriquer des protéines”, a déclaré Lester.
Notamment, les scientifiques examinant le cerveau des patients atteints de la maladie d’Alzheimer après la mort ont découvert des preuves de défauts liés à l’épissage dans les cellules.
Déjà, plusieurs sociétés ont des essais cliniques en cours pour tester des médicaments qui élimineraient complètement le tau chez les patients atteints de maladies neurodégénératives. Mais cela pourrait potentiellement avoir des conséquences imprévues, a déclaré Lester.
“Un gros problème sur le terrain est que personne ne sait vraiment ce que fait le tau chez les personnes en bonne santé et il a probablement des fonctions importantes lorsqu’il n’est pas enchevêtré”, a-t-il déclaré.
En comprenant mieux précisément ce qu’il fait pour endommager et tuer les cellules, Parker et Lester espèrent apporter une approche différente à la table.
“L’idée serait d’intervenir dans les fonctions anormales tout en préservant les fonctions normales de tau”, a déclaré Lester.
Bien qu’il soit peu probable que ses patients actuels bénéficient de sa découverte, un jour, ses futurs patients pourraient bien le faire.
Référence : « Les agrégats Tau sont des assemblages ARN-protéines qui localisent mal plusieurs composants de speckle nucléaire » par Evan Lester, Felicia K. Ooi, Nadine Bakkar, Jacob Ayers, Amanda L. Woerman, Joshua Wheeler, Robert Bowser, George A. Carlson, Stanley B Prusiner et Roy Parker, 12 avril 2021, Neurone.
DOI : 10.1016/j.neuron.2021.03.026