Une étude sponsorisée par le NIAID a évalué la dose chez des adultes entièrement vaccinés avec n’importe quel EUA ou approuvé. COVID-19 vaccin approuvé.
Chez les adultes ayant déjà reçu un schéma complet de l’un des trois vaccins COVID-19 ayant reçu une autorisation d’utilisation en urgence (EUA) ou approuvés par la Food and Drug Administration (FDA), une dose de rappel supplémentaire de l’un de ces vaccins s’est avérée sûre et a déclenché une réponse immunitaire, selon les résultats préliminaires d’un essai clinique rapportés dans le rapport intitulé The New England Journal of Medicine. Ces résultats ont servi de base aux recommandations de la FDA et des Centers for Disease Control and Prevention à la fin de l’automne 2021 pour autoriser les vaccinations de rappel COVID-19 mixtes aux États-Unis. Des données supplémentaires issues de l’essai de phase 1/2 en cours, parrainé par le National Institute of Allergy and Infectious Diseases (NIAID), qui fait partie des National Institutes of Health, sont attendues dans les mois à venir.
Le nouveau rapport décrit les résultats obtenus auprès de 458 adultes qui avaient été entièrement vaccinés avec l’un des trois vaccins EUA COVID-19 au moins 12 semaines avant l’enrôlement et qui n’avaient pas d’antécédents signalés d’infection. SRAS-CoV-2 . Au moment de l’inscription, une seule dose de rappel a été administrée à chaque participant : 150 ont reçu le vaccin Ad26.COV2.S de Janssen/Johnson & ; Johnson ; 154 ont reçu le vaccin mRNA-1273 de Moderna ; et 154 ont reçu le vaccin BNT162b2 de Pfizer-BioNTech. Selon le schéma vaccinal primaire reçu par un participant, le vaccin de rappel était soit différent (mixte ou hétérologue), soit identique (apparié ou homologue) au vaccin initial.
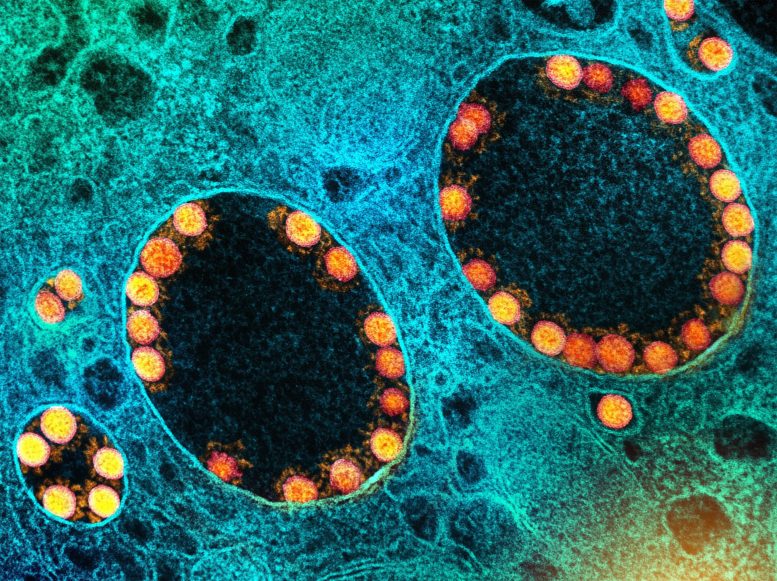
Micrographie électronique à transmission de particules virales SARS-CoV-2 (or) dans les endosomes d’une cellule épithéliale olfactive nasale fortement infectée. Crédit : NIAID
Les participants à l’essai ont tenu un journal des effets secondaires. Plus de la moitié des participants ont signalé des maux de tête, des douleurs au point d’injection, des douleurs musculaires et des malaises. Aucun événement indésirable grave lié au vaccin n’a été signalé.
Toutes les combinaisons de vaccin primaire et de vaccin de rappel ont entraîné une augmentation des taux d’anticorps neutralisants (allant de 4,2 à 76 fois plus élevés que ceux détectés avant le rappel). De même, toutes les combinaisons primaire-boost ont augmenté les niveaux d’anticorps de liaison de 4,6 à 56 fois. Pour chaque vaccin primaire EUA COVID-19, les rappels hétérologues ont suscité des réponses en anticorps similaires ou plus élevées que les réponses à un rappel homologue. Les réponses cellulaires (cellules T CD4 et CD8) ont également augmenté dans tous les groupes, à l’exception du groupe ayant reçu le vaccin homologue Ad26.CoV2.S, bien que les cellules T CD8+ étaient plus nombreuses au départ chez les participants ayant reçu le vaccin EUA Ad26.CoV2.S.
Dans l’ensemble, les investigateurs ont conclu que “ces données suggèrent fortement que les vaccins de rappel homologues et hétérologues augmentent l’efficacité de la protection contre l’infection symptomatique par le SRAS-CoV-2”.
Ces résultats intermédiaires couvrent les données d’immunogénicité disponibles pendant les 29 premiers jours suivant la vaccination de rappel. Les investigateurs continueront à suivre les participants pendant un an afin d’évaluer l’impact de la vaccination de rappel sur les réponses immunitaires à plus long terme. Des bras supplémentaires de l’essai peuvent tester d’autres vaccins COVID-19 expérimentaux, approuvés par l’EUA ou la FDA et/ou des vaccins basés sur des variantes du SRAS-CoV-2 comme vaccin de rappel.
Le site essai a commencé en mai 2021 et continue à recruter des participants. Ses principaux investigateurs sont Robert L. Atmar, M.D., du Baylor College of Medicine, à Houston, et Kirsten E. Lyke, M.D., de la University of Maryland School of Medicine, à Baltimore. Cette étude est menée dans le cadre du programme NIAID. Consortium de recherche clinique sur les maladies infectieusesun réseau d’essais cliniques qui englobe les unités d’évaluation des vaccins et des traitements (VTEU) de l’Institut. Des informations complémentaires sur l’essai, y compris une liste des sites d’essai recrutant des volontaires, sont disponibles à l’adresse suivante ClinicalTrials.gov en utilisant l’identifiant NCT04889209.
Référence : ” Homologous and heterologous COVID-19 booster vaccinations ” par RL Atmar et al, 26 janvier 2022, The New England Journal of Medicine.
DOI : 10.1056/NEJMoa2116414
Les subventions du NIAID soutenant cette recherche étaient les suivantes : UM1AI48372, UM1AI148373, UM1AI148450, UM1AI148452, UM1AI148573, UM1AI148574, UM1AI148575, UM1AI148576, UM1AI148684 et UM1AI148689. Le contrat 75N93019C00050 des Collaborative Influenza Vaccine Innovation Centers (CIVICs) du NIAID a également fournisupport.