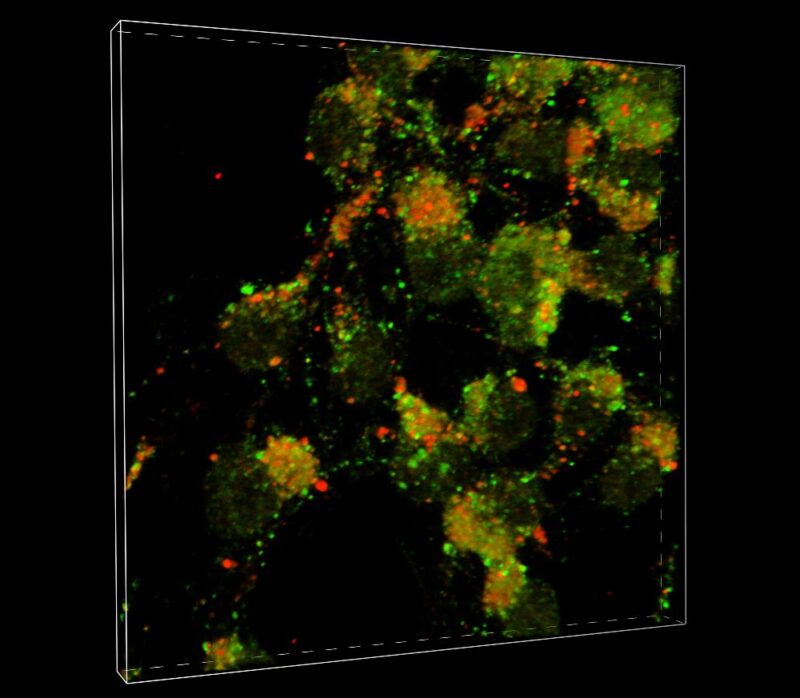
Une équipe du Scripps Research révèle des détails sur le mode de propagation de la maladie de Parkinson et de la démence à corps de Lewy dans le cerveau. Dans les neurones, la protéine LC3 (verte) et la protéine LAMP1 (rouge) fusionnent pour former des autolysomes (jaunes) où se produit l’autophagie, un mécanisme cellulaire d’élimination des protéines mal repliées. La proéminence du vert montre que l’autophagie a été bloquée à l’étape de la fusion, ce qui permet aux protéines mal repliées comme l’alpha-synuceline de se répandre dans le cerveau. Crédit : Scripps Research
Une étude montre comment le blocage du système de gestion cellulaire entraîne l’accumulation et la propagation d’agrégats protéiques anormaux dans le cerveau.
Selon une nouvelle étude menée par des scientifiques du Scripps Research, la maladie de Parkinson pourrait être due en partie à des événements biochimiques liés au stress cellulaire qui perturbent un système de nettoyage cellulaire clé, conduisant à la propagation d’agrégats protéiques nocifs dans le cerveau.
La découverte, publiée dans The Journal of Neuroscience en février 2022, offre une hypothèse claire et testable sur la progression de la maladie de Parkinson, et pourrait conduire à des traitements capables de la ralentir significativement, voire de l’arrêter.
“Nous pensons que nos résultats concernant ce processus apparent de propagation de la maladie sont importants pour le développement de composés capables d’inhiber spécifiquement le processus de propagation de la maladie dans le cerveau”, déclare l’auteur principal de l’étude, Stuart Lipton, MD, PhD, titulaire de la Step Family Endowed Chair, co-directeur fondateur du Neurodegeneration New Medicines Center et professeur au département de médecine moléculaire du Scripps Research.
La maladie de Parkinson touche environ un million de personnes aux États-Unis. Son déclenchement précis est inconnu, mais elle entraîne la mort de neurones selon une séquence caractéristique dans des régions clés du cerveau. La mort d’un petit groupe de neurones producteurs de dopamine dans le mésencéphale entraîne le tremblement parkinsonien classique et d’autres troubles du mouvement. L’atteinte d’autres régions du cerveau entraîne divers autres signes de la maladie, dont la démence aux stades avancés de la maladie de Parkinson. Un syndrome étroitement lié dans lequel la démence survient tôt dans l’évolution de la maladie est appelé démence à corps de Lewy (DLL) et touche environ 1,4 million de personnes aux États-Unis.
Dans les deux maladies, les neurones affectés contiennent des agrégations anormales de protéines, appelées corps de Lewy, dont l’ingrédient prédominant est une protéine appelée alpha-synucléine. Des études antérieures ont montré que les agrégats d’alpha-synucléine peuvent se propager d’un neurone à l’autre dans la maladie de Parkinson et la LBD, transmettant apparemment le processus pathologique dans le cerveau. Mais la manière précise dont les agrégats d’alpha-synucléine s’accumulent et se propagent de cette façon n’est pas claire.
Un indice, découvert par le laboratoire de Lipton et d’autres dans des recherches antérieures, est que le processus de la maladie de Parkinson/LBD génère des molécules azotées hautement réactives, dont l’oxyde nitrique. En principe, ces molécules azotées réactives pourraient perturber d’importants systèmes cellulaires, notamment les systèmes “domestiques” qui gardent normalement les agrégats de protéines sous contrôle.
Dans la nouvelle étude, l’équipe de Scripps Research a démontré la validité de cette idée en montrant qu’un type de réaction des molécules d’azote appelé S-nitrosylation peut affecter une protéine cellulaire importante appelée p62, déclenchant l’accumulation et la propagation des agrégats d’alpha-synucléine.
La protéine p62 participe normalement à l’autophagie, un système de gestion des déchets qui aide les cellules à se débarrasser des agrégats de protéines potentiellement dangereux. Les chercheurs ont trouvé des preuves que dans les modèles cellulaires et animaux de la maladie de Parkinson, la p62 est S-nitrosylée à des niveaux anormalement élevés dans les neurones affectés. Cette altération de la p62 inhibe l’autophagie, provoquant une accumulation d’agrégats d’alpha-synucléine. Cette accumulation d’agrégats entraîne à son tour la sécrétion d’agrégats par les neurones atteints, et certains de ces agrégats sont absorbés par les neurones voisins.
“Le processus que nous avons observé semble très similaire à ce qui est observé dans les cerveaux de la maladie de Parkinson et de la LBD”, déclare le premier auteur de l’étude, Chang-Ki Oh, PhD, un scientifique du laboratoire Lipton.
Les chercheurs ont également testé des cerveaux post-mortem de patients atteints de LBD, et ont de nouveau constaté que les niveaux de p62 S-nitrosylée étaient anormalement élevés dans les zones cérébrales affectées – ce qui confirme l’idée que ce processus se produit chez les humains.
Lipton et Oh affirment que la S-nitrosylation des protéines devient plus probable dans de nombreuses situations de stress cellulaire, notamment en présence d’agrégats de protéines. Ainsi, cette modification chimique de la p62 pourrait être un facteur clé dans un processus d’auto-renforcement qui non seulement stresse les cellules cérébrales au-delà de leurs limites, mais étend également la source de stress à l’ensemble de la population.d’autres cellules du cerveau.
L’équipe travaille maintenant à la mise au point de composés de type médicamenteux qui inhibent spécifiquement la S-nitrosylation de la p62. Bien qu’il faille des années pour développer de tels composés en tant que médicaments commerciaux potentiels, ils pourraient, en principe, ralentir le processus de la maladie de Parkinson/LBD ou empêcher sa propagation dans le cerveau après qu’elle ait commencé, dit Lipton.
Référence : “S-Nitrosylation of p62 Inhibits Autophagic Flux to Promote α-Synuclein Secretion and Spread in Parkinson’s Disease and Lewy Body Dementia” par Chang-ki Oh, Nima Dolatabadi, Piotr Cieplak, Maria T. Diaz-Meco, Jorge Moscat, John P. Nolan, Tomohiro Nakamura et Stuart A. Lipton, 15 février 2022, The Journal of Neuroscience.
DOI: 10.1523/JNEUROSCI.1508-21.2022
L’étude a été co-écrite par Chang-Ki Oh, Nima Dolatabadi, Tomohiro Nakamura et Stuart Lipton, de Scripps Research ; Piotr Cieplak, Maria Diaz-Meco et Jorge Moscat du Sanford Burnham Prebys Medical Discovery Institute ; et John Nolan de l’Institut Scintillon à San Diego.
Cette étude a été soutenue en partie par les National Institutes of Health (R01 NS086890, R35 AG071734, DP1 DA041722, R01 DA048882, RF1 AG057409, R01 AG056259, R01 AG061845, R61 NS122098, RF1 NS123298), la Brain & ; Behavior Research Foundation, et la Michael J. Fox Foundation.