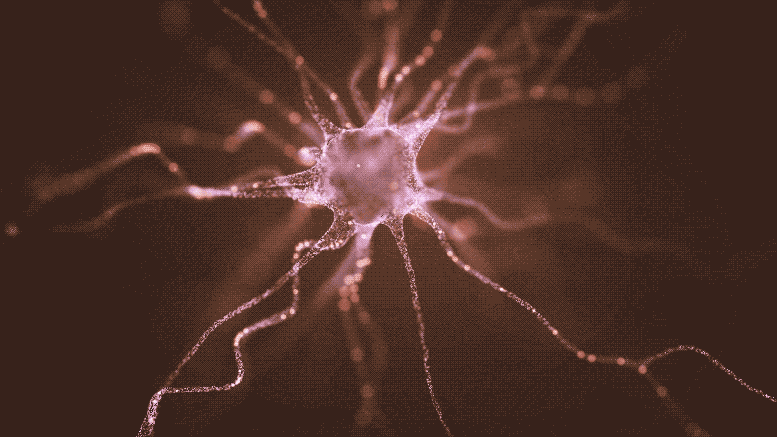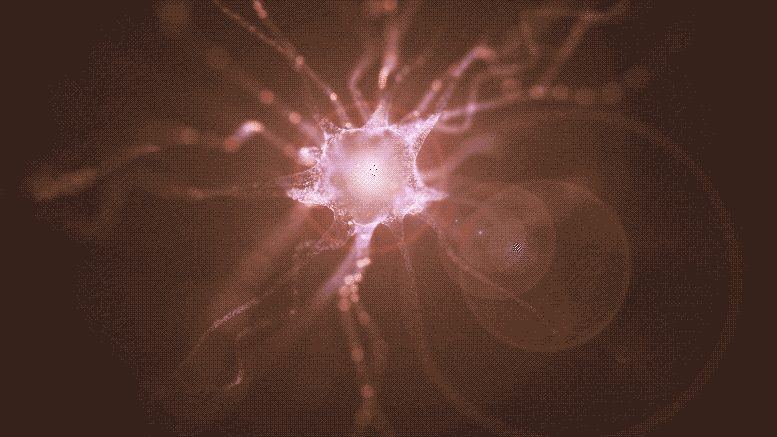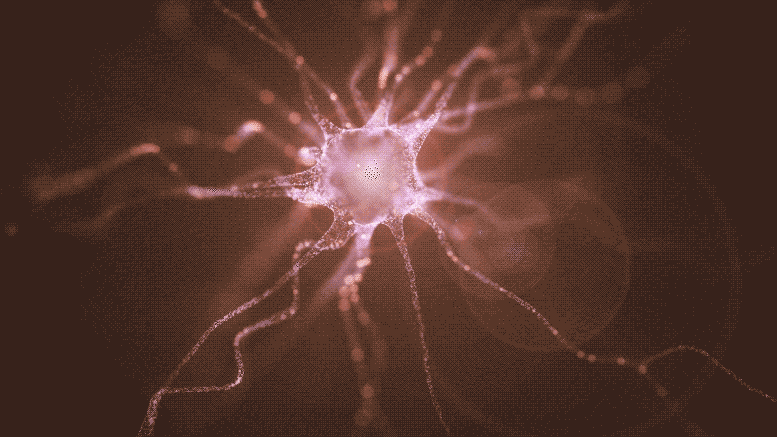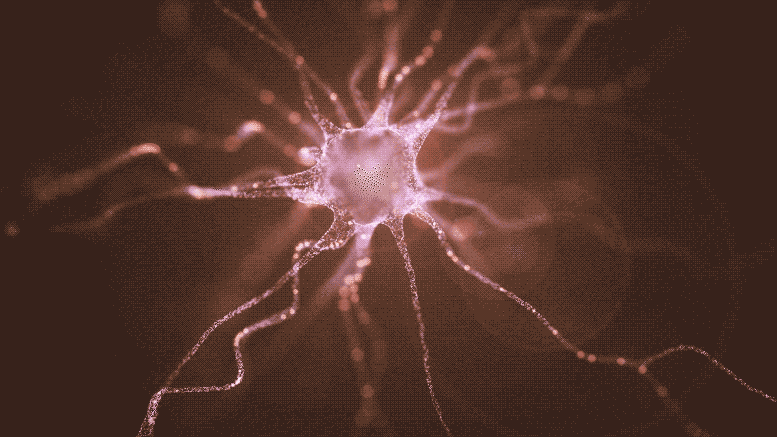
Cette nouvelle recherche décrit l’implantation de cellules souches pluripotentes induites (iPSC) pour remplacer les neurones producteurs de dopamine détruits par la maladie de Parkinson. Non seulement ces cellules survivent à la procédure de greffe et fabriquent de la dopamine, mais elles envoient leurs fibres ramifiées à travers le tissu neuronal pour établir des connexions distantes dans le cerveau, tout comme leurs homologues naturels. Crédit : Shireen Dooling pour le Biodesign Institute de l’Université d’État de l’Arizona.
Les maladies neurodégénératives entraînent la détérioration et la destruction des neurones, causant des ravages sur la santé mentale et physique. La maladie de Parkinson, qui touche plus de 10 millions de personnes dans le monde, ne fait pas exception. Les symptômes les plus visibles de la maladie de Parkinson apparaissent après que la maladie a endommagé une catégorie spécifique de neurones situés dans le mésencéphale. Le résultat est que la dopamine, un neurotransmetteur clé produit par les neurones affectés, est épuisée dans le cerveau.
Dans une nouvelle recherche, Jeffrey Kordower et ses collègues décrivent une méthode permettant de convertir des cellules non neuronales en neurones fonctionnels capables de s’installer dans le cerveau, d’envoyer leurs branches fibreuses à travers le tissu neuronal, de former des synapses, de distribuer de la dopamine et de restaurer les capacités compromises par la destruction des cellules dopaminergiques par la maladie de Parkinson.
L’étude actuelle de preuve de concept révèle qu’un groupe de cellules modifiées expérimentalement fonctionne de manière optimale en termes de survie, de croissance, de connectivité neuronale et de production de dopamine, lorsqu’elles sont implantées dans le cerveau de rats. L’étude démontre que le résultat de telles greffes neuronales est de renverser efficacement les symptômes moteurs causés par la maladie de Parkinson.
La thérapie de remplacement des cellules souches représente une nouvelle stratégie radicale pour le traitement de la maladie de Parkinson et d’autres maladies neurodégénératives. Cette approche futuriste sera bientôt testée dans le cadre du premier essai clinique de ce type, sur une population spécifique de personnes atteintes de la maladie de Parkinson, porteuses d’une mutation du gène parkin. L’essai sera mené à différents endroits, notamment à l’Institut neurologique Barrow de Phoenix, avec Kordower comme investigateur principal.
Le travail est soutenu par une subvention de la Fondation Michael J. Fox.

Jeffrey Kordower dirige le centre de recherche sur les maladies neurodégénératives ASU-Banner à l’Université d’État de l’Arizona et est le directeur distingué de Charlene et J. Orin Edson à l’Institut Biodesign. Crédit : Institut Biodesign de l’université d’État de l’Arizona.
“Nous ne pouvons pas être plus enthousiastes à l’idée d’aider les personnes qui souffrent de cette forme génétique de la maladie de Parkinson, mais les leçons tirées de cet essai auront également un impact direct sur les patients qui souffrent de formes sporadiques, ou non génétiques, de cette maladie”, déclare Kordower.
Kordower dirige le centre de recherche sur les maladies neurodégénératives ASU-Banner à l’Arizona State University et est le directeur distingué de Charlene et J. Orin Edson au Biodesign Institute. La nouvelle étude décrit en détail la préparation expérimentale de cellules souches aptes à être implantées pour inverser les effets de la maladie de Parkinson.
La recherche est publiée dans le numéro actuel de la revue npj. Nature Regenerative Medicine.
Nouvelles perspectives sur la maladie de Parkinson
Il n’est pas nécessaire d’être un neuroscientifique pour identifier un neurone. Ces cellules, avec leur arborescence ramifiée d’axones et de dendrites, sont immédiatement reconnaissables et ne ressemblent à aucun autre type de cellule dans l’organisme. Grâce à leurs impulsions électriques, elles exercent un contrôle méticuleux sur tout, du rythme cardiaque à la parole. Les neurones sont également les dépositaires de nos espoirs et de nos angoisses, la source de notre identité individuelle.
La dégénérescence et la perte des neurones dopaminergiques provoquent les symptômes physiques de rigidité, de tremblement et d’instabilité posturale qui caractérisent la maladie de Parkinson. Les autres effets de la maladie de Parkinson peuvent être la dépression, l’anxiété, les troubles de la mémoire, les hallucinations et la démence.
En raison du vieillissement de la population, l’humanité est confrontée à une crise croissante des cas de maladie de Parkinson, dont le nombre devrait atteindre plus de 14 millions dans le monde d’ici 2040. Les thérapies actuelles, qui comprennent l’utilisation du médicament L-DOPA, ne sont capables de traiter que certains des symptômes moteurs de la maladie et peuvent produire des effets secondaires graves, souvent intolérables, après 5 à 10 ans d’utilisation.
Il n’existe aucun traitement capable de faire reculer la maladie de Parkinson ou d’enrayer son impitoyable progression. Il est impératif d’innover pour faire face à cette situation d’urgence.
Une arme (pluri) puissante contreLa maladie de Parkinson
Malgré l’attrait intuitif du simple remplacement des cellules mortes ou endommagées pour traiter les maladies neurodégénératives, les défis à relever pour réussir à implanter des neurones viables afin de restaurer la fonction sont considérables. De nombreux obstacles techniques ont dû être surmontés avant que les chercheurs, dont Kordower, puissent commencer à obtenir des résultats positifs, en utilisant une catégorie de cellules connues sous le nom de cellules souches.
L’intérêt pour les cellules souches en tant que thérapie intéressante pour toute une série de maladies a rapidement pris de l’ampleur après 2012, lorsque John B. Gurdon et Shinya Yamanaka ont partagé le prix Nobel pour leur percée dans la recherche sur les cellules souches. Ils ont montré que les cellules matures peuvent être reprogrammées, ce qui les rend “pluripotentes” – ou capables de se différencier en n’importe quel type de cellule dans le corps.
Ces cellules souches pluripotentes sont fonctionnellement équivalentes aux cellules souches fœtales, qui s’épanouissent pendant le développement embryonnaire, migrant vers leur lieu de résidence et se développant en cœur, nerf, poumon et autres types de cellules, dans l’une des transformations les plus remarquables de la nature.
L’alchimie neuronale
Il existe deux types de cellules souches adultes. La première se trouve dans les tissus entièrement développés, comme la moelle osseuse, le foie et la peau. Ces cellules souches sont peu nombreuses et se développent généralement en un type de cellules appartenant au tissu dont elles sont issues.
Le deuxième type de cellules souches adultes (et l’objet de cette étude) est connu sous le nom de cellules souches pluripotentes induites (iPSC). La technique de production des iPSC utilisées dans l’étude se déroule en deux phases. D’une certaine manière, les cellules sont amenées à voyager dans le temps, d’abord en sens inverse, puis en sens direct.
Dans un premier temps, les cellules sanguines adultes sont traitées avec des facteurs de reprogrammation spécifiques qui les font revenir à l’état de cellules souches embryonnaires. Dans un deuxième temps, ces cellules souches embryonnaires sont traitées avec des facteurs supplémentaires, ce qui les amène à se différencier en cellules cibles souhaitées – des neurones produisant de la dopamine.
“La principale conclusion du présent article est que le moment où l’on administre la deuxième série de facteurs est crucial”, déclare Kordower. “Si vous les traitez et les mettez en culture pendant 17 jours, puis arrêtez leurs divisions et les différenciez, cela fonctionne mieux.”
Des neurones parfaits
Les expériences de l’étude comprenaient des iPSC cultivées pendant 24 et 37 jours, mais celles cultivées pendant 17 jours avant leur différenciation en neurones dopaminergiques étaient nettement supérieures, capables de survivre en plus grand nombre et d’envoyer leurs branches sur de longues distances. “C’est important”, dit Kordower, “parce qu’elles devront se développer sur de longues distances dans le cerveau humain plus grand et nous savons maintenant que ces cellules sont capables de le faire.”
Les rats traités avec les iPSC de 17 jours ont montré une récupération remarquable des symptômes moteurs de la maladie de Parkinson. L’étude démontre en outre que cet effet est dépendant de la dose. Lorsqu’un petit nombre de iPSC a été greffé dans le cerveau de l’animal, la guérison était négligeable, mais un complément important de cellules a produit une ramification neuronale plus abondante et une inversion complète des symptômes de la maladie de Parkinson.
L’essai clinique initial appliquera la thérapie iPSC à un groupe de patients atteints de la maladie de Parkinson porteurs d’une mutation génétique particulière, connue sous le nom de mutation Parkin. Ces patients souffrent des symptômes typiques de dysfonctionnement moteur que l’on retrouve dans la maladie de Parkinson générale ou idiopathique, mais ne souffrent pas de déclin cognitif ou de démence. Cette cohorte de patients constitue un terrain d’essai idéal pour la thérapie de remplacement cellulaire. Si le traitement est efficace, des essais de plus grande envergure suivront, appliquant la stratégie à la version de la maladie de Parkinson qui affecte la plupart des patients atteints de la maladie.
En outre, le traitement pourrait potentiellement être associé aux thérapies existantes pour traiter la maladie de Parkinson. Une fois que le cerveau a été ensemencé de cellules de remplacement produisant de la dopamine, des doses plus faibles de médicaments comme la L-DOPA pourraient être utilisées, ce qui atténuerait les effets secondaires et renforcerait les résultats bénéfiques.
Cette recherche ouvre la voie au remplacement des neurones endommagés ou morts par des cellules fraîches pour un large éventail de maladies dévastatrices.
“Les patients atteints de la maladie de Huntington ou d’une atrophie du système multiple ou même Alzheimer’s disease could be treated in this way for specific aspects of the disease process,” Kordower says.
Reference: “Optimizing maturity and dose of iPSC-derived dopamine progenitor cell therapy for Parkinson’s disease” by Benjamin M. Hiller, David J. Marmion, Cayla A. Thompson, Nathaniel A. Elliott, Howard Federoff, Patrik Brundin, Virginia B. Mattis, Christopher W. McMahon and Jeffrey H. Kordower, 21 April 2022, npj Regenerative Medicine.
DOI: 10.1038/s41536-022-00221-y