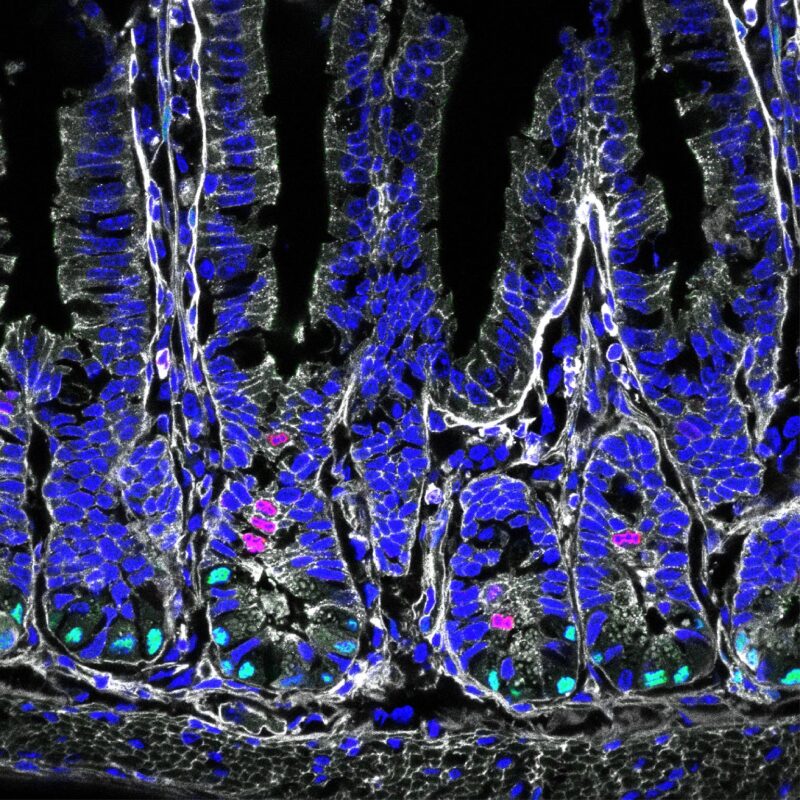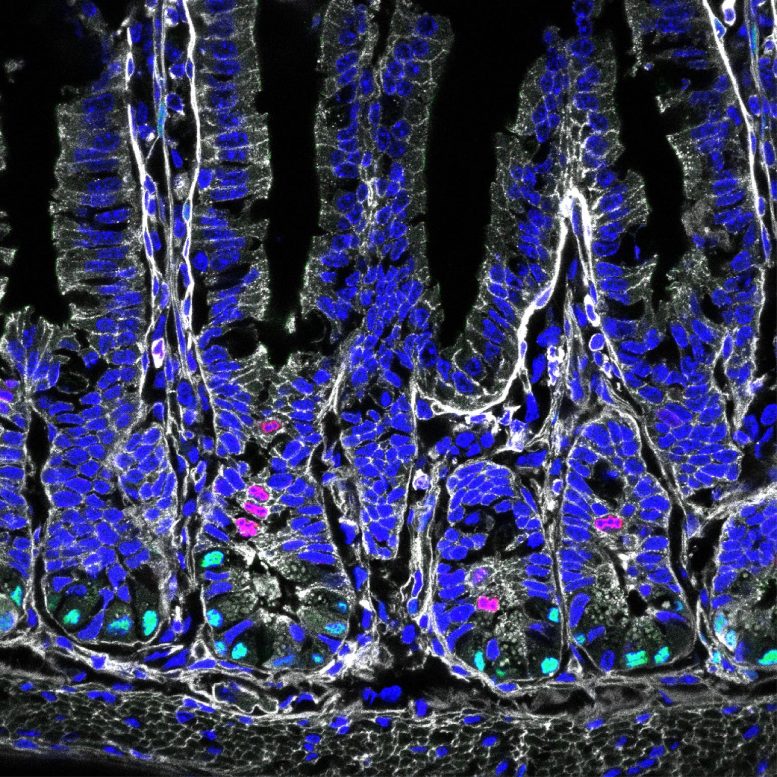
Cellules souches intestinales en vert, division cellulaire en rouge. Crédit : Helmholtz Munich / Anika Böttcher
L’intestin est essentiel au maintien de notre équilibre énergétique et est passé maître dans l’art de réagir rapidement aux changements de nutrition et d’équilibre nutritionnel. Il y parvient à l’aide de cellules intestinales qui sont entre autres spécialisées dans l’absorption de composants alimentaires ou la sécrétion d’hormones. Chez l’homme adulte, les cellules intestinales se régénèrent tous les cinq à sept jours. La capacité de renouveler et de développer constamment tous les types de cellules intestinales à partir de cellules souches intestinales est cruciale pour l’adaptabilité naturelle du système digestif. Cependant, une alimentation à long terme riche en sucre et en graisses perturbe cette adaptation et peut contribuer au développement de l’obésité, du diabète de type 2 et du cancer gastro-intestinal.
Les mécanismes moléculaires à l’origine de cette inadaptation font partie du domaine de recherche de Heiko Lickert et de son groupe à Helmholtz Munich et à l’Université technique de Munich. Les scientifiques supposent que les cellules souches intestinales jouent un rôle particulier dans la maladaptation. À l’aide d’un modèle murin, les chercheurs ont étudié les effets d’un régime riche en sucre et en graisses et l’ont comparé à un groupe témoin.
D’un régime hypercalorique à un risque accru de cancer gastro-intestinal
“La première chose que nous avons remarquée, c’est que la taille de l’intestin grêle augmente considérablement avec le régime riche en calories”, explique Anika Böttcher, responsable de l’étude. « En collaboration avec l’équipe de biologistes computationnels de Fabian Theis à Helmholtz Munich, nous avons ensuite profilé 27 000 cellules intestinales provenant d’un régime témoin et de souris nourries avec un régime riche en graisses et en sucre. En utilisant de nouvelles techniques d’apprentissage automatique, nous avons ainsi découvert que les cellules souches intestinales se divisent et se différencient significativement plus rapidement chez les souris ayant un régime alimentaire malsain. Les chercheurs émettent l’hypothèse que cela est dû à une régulation à la hausse des voies de signalisation pertinentes, qui est associée à une accélération de la croissance tumorale dans de nombreux cancers. « Cela pourrait être un lien important : l’alimentation influence la signalisation métabolique, ce qui entraîne une croissance excessive des cellules souches intestinales et, finalement, un risque accru de cancer gastro-intestinal », explique Böttcher.
À l’aide de cette technique à haute résolution, les chercheurs ont également pu étudier des types de cellules rares dans l’intestin, par exemple des cellules sécrétant des hormones. Parmi leurs découvertes, ils ont pu montrer qu’une mauvaise alimentation entraîne une réduction des cellules productrices de sérotonine dans l’intestin. Cela peut entraîner une inertie intestinale (typique du diabète sucré) ou une augmentation de l’appétit. De plus, l’étude a montré que les cellules absorbantes s’adaptent au régime riche en graisses et que leur fonctionnalité augmente, favorisant ainsi directement la prise de poids.
Recherche fondamentale importante pour les thérapies non invasives
Ces résultats et d’autres de l’étude conduisent à une nouvelle compréhension des mécanismes de la maladie associés à un régime riche en calories. “Ce que nous avons découvert est d’une importance cruciale pour le développement de thérapies alternatives non invasives”, a déclaré le chef de l’étude Heiko Lickert, en résumant les résultats. À ce jour, il n’existe aucune approche pharmacologique pour prévenir, arrêter ou inverser l’obésité et le diabète. Seule la chirurgie bariatrique entraîne une perte de poids permanente et peut même conduire à une rémission du diabète. Cependant, ces chirurgies sont invasives, irréversibles et coûteuses pour le système de santé. De nouvelles thérapies non invasives pourraient se produire, par exemple, au niveau hormonal grâce à une régulation ciblée des niveaux de sérotonine. Le groupe de recherche examinera cette approche et d’autres dans des études ultérieures.
Référence : « Altération induite par le régime de la fonction des cellules souches intestinales sous-jacentes à l’obésité et au prédiabète chez la souris » par Alexandra Aliluev, Sophie Tritschler, Michael Sterr, Lena Oppenländer, Julia Hinterdobler, Tobias Greisle, Martin Irmler, Johannes Beckers, Na Sun, Axel Walch, Kerstin Stemmer, Alida Kindt, Jan Krumsiek, Matthias H. Tschöp, Malte D. Luecken, Fabian J. Theis, Heiko Lickert et Anika Böttcher, 22 septembre 2021, Métabolisme naturel.
DOI : 10.1038 / s42255-021-00458-9
Heiko Lickert et Anika Böttcher mènent des recherches au Helmholtz Diabetes Center de Helmholtz Munich. Ils se spécialisent dans le développement d’approches thérapeutiques régénératives pour de nombreuses maladies répandues associées à une altération de la fonction intestinale. Lickert dirige l’Institut de recherche sur le diabète et la régénération et est professeur à l’Université technique de Munich (TUM). Tous deux sont des scientifiques du Centre allemand de recherche sur le diabète (DZD).
La présente étude a été publiée en couverture dans Métabolisme naturel.