Lorsque les cyanobactéries vivent dans des conditions de faible luminosité, par exemple sous la surface d’un étang ou sous le couvert végétal d’une forêt, certaines sont capables de passer de l’utilisation de la lumière visible, qui est la plus propice à leur croissance et à leurs activités photosynthétiques, à la récolte de la lumière solaire rouge lointain, plus faible, qui filtre jusqu’à elles. L’étude actuelle fournit la base structurelle de la capacité de ces cyanobactéries à utiliser la lumière rouge lointaine pour la photosynthèse à base d’oxygène. Crédit : Shireen Dooling, Institut de biodesign de l’Université d’État de l’Arizona.
Une équipe de chercheurs dirigée par des scientifiques de Penn State a identifié l’emplacement des changements dans l’appareil photosynthétique de certaines cyanobactéries – anciennement connues sous le nom d'”algues bleues” – qui permettent à ces organismes de se développer en utilisant la lumière rouge lointaine. À l’aide de la cryo-microscopie électronique à haute résolution (cryo-EM), les chercheurs ont localisé les emplacements de deux complexes photosynthétiques dans les cyanobactéries qui incorporent des versions alternatives de pigments chlorophylliens. Ces variantes sont adaptées à des longueurs d’onde plus importantes, ce qui permet aux cyanobactéries d’utiliser efficacement la lumière rouge lointaine pour réaliser la photosynthèse qui produit de l’oxygène. Si l’on considère que l’énergie disponible dans la lumière rouge lointaine équivaut à 15 % du rayonnement solaire total atteignant la Terre, cette capacité donne à ces organismes un avantage dans la compétition avec les plantes et les autres cyanobactéries pour la lumière nécessaire à la photosynthèse.
Les structures sont décrites dans deux articles publiés en ligne dans le bulletin d’information de la Commission européenne. Journal of Biological Chemistry et pourraient éventuellement aider les chercheurs à concevoir des plantes cultivées capables d’utiliser un spectre lumineux de plus grande longueur d’onde pour leur croissance.
“Si vous m’aviez demandé il y a 10 ans si vous pouviez cultiver la plupart des cyanobactéries dans une lumière rouge lointaine, j’aurais ri”, a déclaré Donald A. Bryant, titulaire de la chaire Ernest C. Pollard en biotechnologie et professeur de biochimie et de biologie moléculaire à Penn State et chef de l’équipe de recherche. “Mais il s’avère que si vous les mettez en lumière rouge lointaine, certaines cyanobactéries activent un ensemble d’environ 20 gènes qui leur permettent de modifier leur appareil photosynthétique et les chlorophylles qu’elles produisent afin qu’elles puissent utiliser la lumière rouge lointaine pour la photosynthèse. Depuis que nous avons fait cette découverte en 2013, nous avons essayé de comprendre comment cela fonctionne.”
Les cyanobactéries sont des bactéries qui obtiennent de l’énergie par une photosynthèse productrice d’oxygène et que l’on trouve presque partout, y compris dans des environnements extrêmes comme les sources chaudes, les déserts et les régions polaires. Elles comptent parmi les organismes les plus anciens sur Terre et on pense que leur capacité à produire de l’oxygène par photosynthèse a joué un rôle important dans les changements survenus dans l’atmosphère de la Terre primitive, qui ont ouvert la voie à l’évolution de formes de vie diverses et complexes. Ils sont également d’importants organismes modèles, avec des applications potentielles pour la production de bioéthanol, comme compléments alimentaires et comme colorants alimentaires.
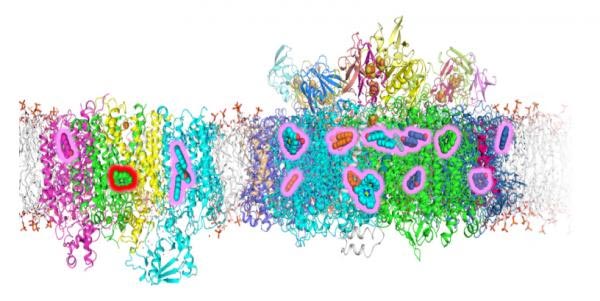
Structures du photosystème I (à droite) et du photosystème II (à gauche) de cellules cyanobactériennes cultivées en lumière rouge lointaine. Deux nouvelles études ont permis de localiser les modifications de ces complexes qui permettent aux cyanobactéries d’utiliser la lumière rouge lointaine pour la photosynthèse. Lorsqu’elles sont cultivées dans la lumière rouge lointaine, les cellules remplacent plusieurs molécules de chlorophylle a par de la chlorophylle f (lueur rose) dans les complexes du photosystème et une seule chlorophylle a est remplacée par de la chlorophylle d dans le photosystème II (lueur rouge). Cette unique molécule de chlorophylle d est le centre fonctionnel du photosystème II et le site où la lumière déclenche le transfert d’électrons qui initie le processus d’oxydation de l’eau pour produire de l’oxygène. Crédit : Girsiel, et al. JBC 297, 101408 et Gisriel, et al. JBC 297, 101424
Lorsqu’elles sont cultivées dans des conditions normales de lumière “blanche”, c’est-à-dire la lumière visible, qui va de la lumière violette avec une longueur d’onde d’environ 400 nm au rouge à 700 nm, les cyanobactéries récoltent cette lumière en utilisant principalement la chlorophylle. aqui absorbe la lumière avec des longueurs d’onde allant jusqu’à un maximum d’environ 700 nm. Lorsqu’elles sont cultivées en lumière rouge lointaine (jusqu’à environ 800 nm), certaines cyanobactéries terrestres convertissent une partie de cette chlorophylle a en chlorophylle a . aen chlorophylle d et f qui absorbent de plus grandes longueurs d’onde de la lumière. Ces formes alternatives de chlorophylle donnent à ces organismes la capacité de récolter la lumière rouge lointaine et de l’utiliser efficacement pour la photosynthèse, ce qui permet à ces cyanobactéries de prospérer dans des environnements à lumière faible ou filtrée, comme c’est le cas sous les plantes ou les arbres.
“Nous savions, grâce à l’isolement et à la caractérisation des complexes, que le photosystème I contient 7 ou 8 chlorophylles. f et que le photosystème II contient une molécule de chlorophylle. det 4 à 5 molécules de chlorophylle f ainsi qu’environ 90 % de la chlorophylle originale. a Nous voulions donc savoir où ces changements se produisaient dans les complexes”, a déclaré Bryant. Nous voulions donc savoir où ces changements se produisaient dans les complexes”, a déclaré Bryant. “Une façon de le découvrir est de déterminer la structure des complexes, mais comme ils sont si grands et complexes – et que les différences chimiques sont si mineures – c’était extrêmement difficile.”
Les complexes des photosystèmes I et II sont très difficiles à cristalliser – parce qu’il s’agit de complexes membranaires de très grande taille – et la cristallographie aux rayons X, une méthode de laboratoire standard pour déterminer les structures tridimensionnelles des molécules, n’avait aucune chance de fonctionner. Les chercheurs se sont alors tournés vers la cryo-EM, mais les minuscules différences entre les formes des molécules de chlorophylle dépassaient les limites de la résolution de la cryo-EM. Les chlorophylles ne diffèrent que par quelques atomes de masse similaire.
“Mon collaborateur, Chris Gisriel, qui est chercheur postdoctoral dans le laboratoire de Gary Brudvig à Yale, a eu la chance d’obtenir une structure à très haute résolution pour le complexe du photosystème II – 2,25 angströms (Å) – ce qui lui a permis de visualiser directement les différences entre certaines chlorophylles”, a déclaré Bryant. “L’ampleur de la différence entre la chlorophylle a et f est que deux atomes d’hydrogène sont remplacés par un oxygène atome d’oxygène dans une molécule dont la composition est C55H72MgN4O5. Dans un complexe comme le photosystème I qui contient près de 100 molécules de pigment et 11 sous-unités protéiques ou le photosystème II avec 35 chlorophylles et 20 sous-unités protéiques, ces petites modifications reviennent à chercher quelques aiguilles dans deux très grandes bottes de foin. Comme ces chlorophylles confèrent les propriétés particulières qui permettent l’utilisation de la lumière rouge lointaine, il est très important de comprendre exactement comment ces molécules sont disposées.”
La plupart du temps, les atomes d’oxygène sont liés par des liaisons hydrogène. Les chercheurs peuvent donc rechercher les donneurs de liaisons hydrogène qui se trouvent aux bons endroits dans les molécules de chlorophylle. En appliquant cette méthode et d’autres aux structures déterminées à l’aide de la cryo-EM, ils ont pu identifier les emplacements de la chlorophylle. fdans les deux complexes de photosystème et la position de la molécule unique de chlorophylle f . ddans le photosystème II.
“L’identification de la base structurelle de la façon dont cette absorption de la lumière rouge lointaine se produit dans la nature est une étape importante”, a déclaré Gisriel, premier auteur des deux études. “L’identification des emplacements précis dans les complexes du photosystème I et II où les formes alternatives de chlorophylle sont incorporées pourrait ouvrir la voie à des applications futures passionnantes. Par exemple, les cultures pourraient être modifiées pour récolter la lumière au-delà du spectre visible. En outre, il serait possible de faire pousser deux plantes ensemble, les plus petites utilisant la lumière rouge lointaine filtrée provenant de leur emplacement ombragé sous les plantes plus grandes. Alternativement, les plantes pourraient être cultivées plus près les unes des autres en raison d’une meilleure capture de la lumière dans les feuilles sous la canopée.”
Outre Bryant et Gisriel, l’équipe de recherche du premier article, intitulé “Structure of a photosystem I-ferredoxin complex from a marine cyanobacterium provides insights into far-red light photoacclimation”, comprend David A. Flesher, Gaozhong Shen, Jimin Wang, Ming-Yang Ho et Gary W. Brudvig. Le financement a été assuré par la Fondation nationale des sciences des États-Unis et le Département de l’énergie des États-Unis, Bureau des sciences énergétiques de base, Division des sciences chimiques.
L’équipe de recherche pour le second article, intitulé “Structure of a monomeric photosystem II core complex from a cyanobacterium acclimated to far-red light reveals the functions of chlorophylls d and f”, comprend Gaozhong Shen, Ming-Yang Ho, Vasily Kurashov, David A. Flesher, Jimin Wang, William H. Armstrong, John H. Golbeck, M.R. Gunner, David J. Vinyard, Richard J. Debus, et Gary W. Brudvig. Cette recherche a été soutenue par la Fondation nationale des sciences des États-Unis, le Département de l’énergie des États-Unis, le Bureau des sciences énergétiques de base, la Division des sciences chimiques, le Département de l’énergie des États-Unis, la Division des sciences chimiques, des géosciences et des biosciences, les systèmes de photosynthèse, et l’Institut national des sciences médicales générales des Instituts nationaux de la santé des États-Unis.
Références :
“La structure d’un complexe photosystème I-ferredoxine d’une cyanobactérie marine fournit des informations sur la photoacclimatation à la lumière rouge lointaine” parChristopher J. Gisriel, David A. Flesher, Gaozhong Shen, Jimin Wang, Ming-Yang Ho, Gary W. Brudvig et Donald A. Bryant, janvier 2022, Journal of Biological Chemistry.
DOI : 10.1016/j.jbc.2021.101408
“La structure d’un complexe central monomère du photosystème II provenant d’une cyanobactérie acclimatée à la lumière rouge lointaine révèle les fonctions des chlorophylles”.detf“par Christopher J. Gisriel, Gaozhong Shen, Ming-Yang Ho, Vasily Kurashov, David A. Flesher, Jimin Wang, William H. Armstrong, John H. Golbeck, Marilyn R. Gunner, David J. Vinyard, Richard J. Debus, Gary W. Brudvig et Donald A. Bryant, janvier 2022,Journal of Biological Chemistry.
DOI : 10.1016/j.jbc.2021.101424