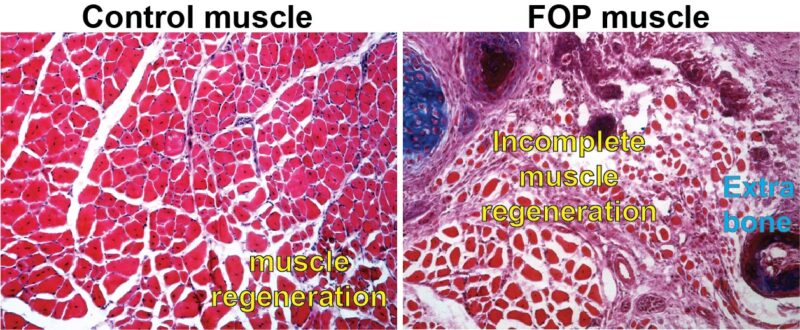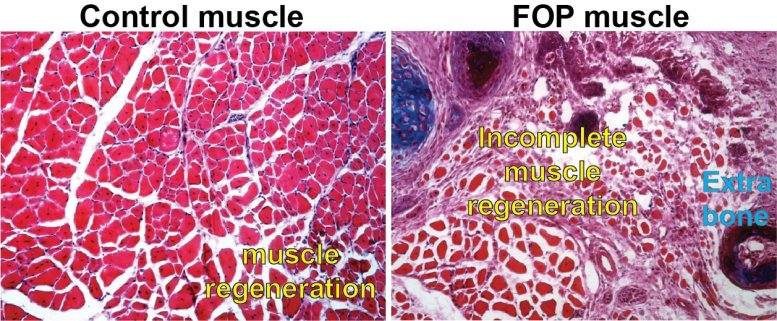
Image d’une cellule témoin présentant une régénération musculaire normale comparée à une cellule présentant la même mutation génétique que les personnes atteintes de FOP. Crédit : avec l’aimable autorisation de Penn Medicine
La fibrodysplasie ossifiante progressive (FOP) est une maladie rare caractérisée par une croissance osseuse importante en dehors du squelette normal, qui empêche les réactions normales de l’organisme aux blessures, même mineures. Il en résulte ce que certains appellent un “second squelette”, qui bloque les mouvements des articulations et peut rendre la respiration difficile. Cependant, de nouvelles recherches menées sur des souris par une équipe de l’école de médecine Perelman de l’université de Pennsylvanie montrent que la formation d’os extra-squelettique pourrait ne pas être le seul moteur de la maladie. Une régénération déficiente et inefficace du tissu musculaire semble ouvrir la voie à la formation d’os indésirable dans des zones où de nouveaux muscles devraient apparaître après une blessure. Cette découverte ouvre la voie à de nouvelles thérapies pour la FOP. NPJ Regenerative Medicine.
“Bien que nous ayons fait de grands progrès vers une meilleure compréhension de cette maladie, ce travail montre comment la biologie fondamentale peut fournir de grandes idées sur les thérapies de médecine régénérative appropriées”, a déclaré l’auteur principal de l’étude, Foteini Mourkioti, PhD, professeur adjoint de chirurgie orthopédique et de biologie cellulaire et développementale, ainsi que co-directeur du Penn Institute for Regenerative Medicine, Musculoskeletal Program. “Depuis le laboratoire, nous sommes maintenant en mesure de montrer qu’il existe un potentiel pour un tout nouveau domaine de thérapies pour les patients atteints de cette maladie dévastatrice.”
Il y a environ 15 ans, des chercheurs de Penn – dont le co-auteur de cette étude, Eileen Shore, PhD, professeur de chirurgie orthopédique et de génétique et co-directrice du Centre de recherche sur la FOP et les troubles associés – ont découvert que la FOP était une maladie chronique. a découvert qu’une mutation dans le gène ACVR1 était responsable de la FOP. Dans cette étude, l’équipe a constaté que la mutation modifiait les cellules des muscles et des tissus conjonctifs, en orientant les cellules de ces tissus de manière à ce qu’elles se comportent comme des cellules osseuses, ce qui entraîne la formation d’os extra-squelettiques nouveaux et inutiles dans le corps.
“Cependant, alors que les recherches sur la façon dont la mutation FOP modifie la régulation des décisions relatives au destin des cellules ont été largement poursuivies ces dernières années, peu d’attention a été accordée aux effets de la mutation génétique sur le muscle et à son impact sur les cellules qui réparent les blessures musculaires”, a déclaré Shore. “Nous étions convaincus que la poursuite des recherches dans ce domaine pourrait fournir des indices non seulement pour prévenir la formation d’os supplémentaires, mais aussi pour améliorer la fonction et la régénération musculaires, apportant une nouvelle clarté à la FOP dans son ensemble.”
Les chercheurs ont étudié les muscles de souris présentant la même mutation du gène ACVR1 que les personnes atteintes de FOP. Ils se sont concentrés sur deux types spécifiques de cellules souches du tissu musculaire : les progéniteurs fibro-adipogénétiques (FAP) et les cellules souches musculaires (MuSC). En général, la réparation d’une blessure musculaire nécessite un équilibre minutieux entre ces deux types de cellules. Le tissu lésé réagit par une expansion des cellules FAP, qui sont chargées de recruter les cellules souches musculaires qui régénéreront le tissu musculaire endommagé. Après environ trois jours, les FAPs meurent, leur travail étant terminé. Dans le même temps, les CSM passent à un état plus mature et différencié, appelé fibre musculaire, essentiel au mouvement organisé de nos muscles.
Chez les souris porteuses de la mutation ACVR1 que Mourkioti, Shore et leurs co-auteurs ont étudiées, l’apoptose – le processus par lequel les cellules FAP meurent dans le cadre d’une régénération musculaire appropriée – avait ralenti de manière significative, entraînant une présence élevée de FAP au-delà de leur durée de vie habituelle. Cela a modifié leur équilibre avec les CSM. Le tissu lésé a également montré une capacité réduite de maturation des cellules souches musculaires et, par conséquent, les fibres musculaires étaient considérablement plus petites chez les souris porteuses de la mutation ACVR1 par rapport aux fibres musculaires des souris sans mutation.
“La persistance prolongée des FAP malades dans le muscle en régénération contribue à l’environnement musculaire altéré dans la FOP, ce qui réduit la régénération musculaire et permet aux FAP surabondantes de contribuer à la formation d’os extra-squelettiques”, a déclaré Mourkioti. “Cela offre une perspective totalement nouvelle sur la façon dont l’excès d’os extra-squelettique se forme – et sur la façon dont il pourrait être prévenu.”
Les cibles actuelles du traitement de la FOP se concentrent sur le ralentissement de la croissance osseuse extra-squelettique. Cette recherche pourrait donner une nouvelle orientation décisive. “Nous proposons que les interventions thérapeutiques envisagent de promouvoir le potentiel de régénération des muscles en même temps que la réduction de la formation osseuse ectopique”, ont écrit Shore et Mourkioti. “En s’attaquant à ces deuxLes populations de cellules souches et leur rôle dans l’origine de la FOP pourraient permettre d’améliorer considérablement les thérapies.”
Cette étude a été soutenue par le National Institute of Arthritis and Musculoskeletal and Skin Diseases (R01-AR041916-15S1, F31-AR069982), les National Institutes of Health (R01-AR071399, NIH P30-AR069619) et l’International Fibrodysplasia Ossificans Progressiva Association (IFOPA).
Les autres auteurs de l’étude sont Alexandra Stanley, Elisia Tichy, Jacob Kocan et Douglas Roberts.
Référence : “Dynamique des cellules souches résidant dans les muscles squelettiques pendant la myogenèse dans la fibrodysplasie ossifiante progressive” par Alexandra Stanley, Elisia D. Tichy, Jacob Kocan, Douglas W. Roberts, Eileen M. Shore et Foteini Mourkioti, 14 janvier 2022, npj Médecine régénérative.
DOI: 10.1038/s41536-021-00201-8