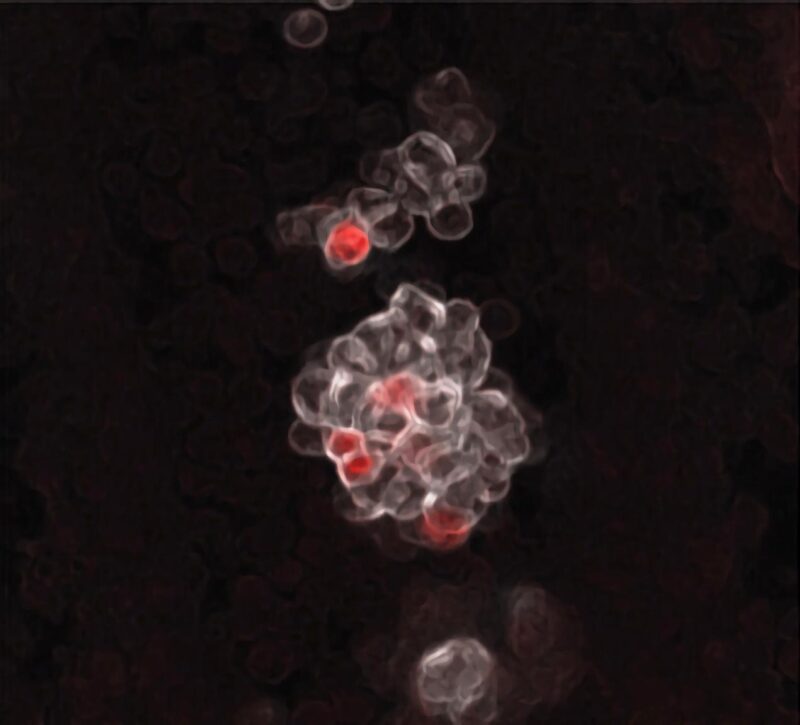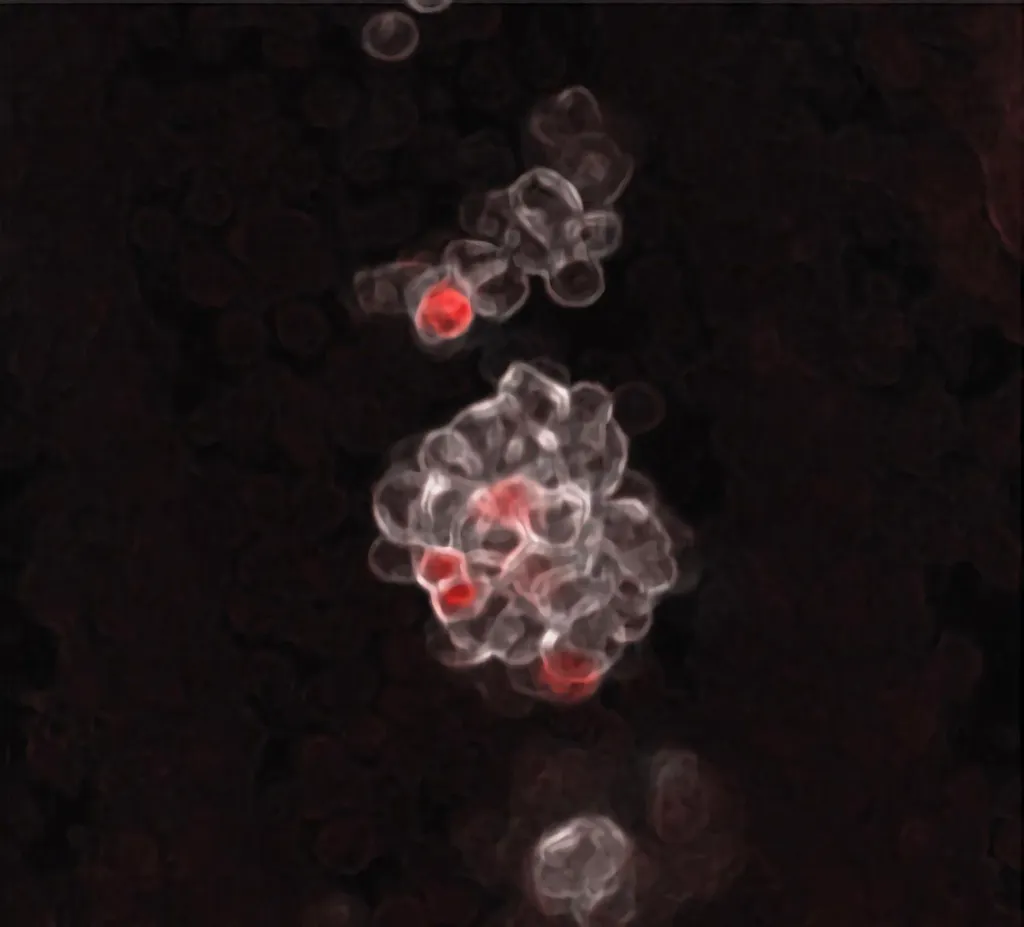
Amas des premières cellules hématopoïétiques naissant dans les parois de l’artère ombilicale d’un embryon de souris. Les cellules colorées en rouge représentent les cellules progénitrices multipotentes embryonnaires (eMPP). Crédit : Sachin H. Patel/Boston Children’s Hospital
Une nouvelle recherche révolutionnaire bouleverse la compréhension de la formation du sang
Des études de “code-barres” ont permis de découvrir deux sources indépendantes de cellules sanguines chez la souris. Si cette découverte est confirmée chez l’homme, notre compréhension des cancers du sang, des greffes de moelle osseuse et du vieillissement du système immunitaire s’en trouvera modifiée.
Les origines de notre sang ne sont peut-être pas tout à fait ce que nous pensions. En utilisant le “code-barres” cellulaire chez la souris, une recherche révolutionnaire a révélé que les cellules sanguines ne proviennent pas d’un seul type de cellule mère, mais de deux, avec des implications potentielles pour les cancers du sang, les transplantations de moelle osseuse et l’immunologie. Fernando Camargo, PhD, du programme des cellules souches de l’hôpital pour enfants de Boston, a dirigé l’étude, publiée dans le journal Nature le 15 juin 2022.
“Historiquement, les gens ont cru que la plupart de notre sang provient d’un très petit nombre de cellules qui finissent par devenir des cellules souches du sang, également connues sous le nom de cellules souches hématopoïétiques”, explique Camargo, qui est également membre du Harvard Stem Cell Institute et professeur à l’Université de Harvard. “Nous avons été surpris de trouver un autre groupe de cellules progénitrices qui ne proviennent pas de cellules souches. Elles fabriquent la majeure partie du sang dans la vie fœtale jusqu’au début de l’âge adulte, puis commencent à diminuer progressivement.”
Les chercheurs effectuent maintenant un suivi pour voir si les résultats s’appliquent également aux humains. Si c’est le cas, ces cellules, connues sous le nom de cellules progénitrices embryonnaires multipotentes (eMPP), pourraient éventuellement servir de base à de nouveaux traitements visant à renforcer le système immunitaire des personnes âgées. Elles pourraient également apporter un nouvel éclairage sur les cancers du sang, en particulier ceux des enfants, et contribuer à rendre les greffes de moelle osseuse plus efficaces.
Les “codes-barres” cellulaires
L’équipe de Camargo appliquée une technique de code-barres développée il y a plusieurs années.. À l’aide d’une enzyme appelée transposase ou de l’édition de gènes CRISPR, ils ont inséré des séquences génétiques uniques dans des cellules embryonnaires de souris de telle sorte que toutes les cellules qui en descendent portent également ces séquences. L’équipe a ainsi pu suivre l’émergence de tous les différents types de cellules sanguines et leur origine, jusqu’à l’âge adulte.
“Auparavant, les gens ne disposaient pas de ces outils”, explique M. Camargo. “De plus, l’idée que les cellules souches donnent naissance à toutes les cellules sanguines était tellement ancrée dans le domaine que personne ne tentait de la remettre en question. En suivant ce qui se passait chez les souris au fil du temps, nous avons été en mesure de voir une nouvelle biologie.”
Comprendre le vieillissement du système immunitaire
Grâce au code-barres, les chercheurs ont découvert que les eMPP, par rapport aux cellules souches sanguines, sont une source plus abondante de la plupart des cellules lymphoïdes importantes pour les réponses immunitaires, comme les cellules B et les cellules T. Selon Camargo, la diminution des eMPP qu’ils ont observée avec l’âge pourrait expliquer pourquoi l’immunité des gens s’affaiblit avec l’âge.
“Nous essayons maintenant de comprendre pourquoi ces cellules s’affaiblissent à l’âge moyen, ce qui pourrait nous permettre de les manipuler dans le but de rajeunir le système immunitaire”, déclare Camargo.
En théorie, il pourrait y avoir deux approches : prolonger la vie des cellules eMPP, peut-être par le biais de facteurs de croissance ou de molécules de signalisation immunitaire, ou traiter les cellules souches sanguines par thérapie génique ou d’autres approches pour les rendre plus semblables aux eMPP.
Le déballage des cancers du sang
Camargo est également enthousiasmé par les implications potentielles pour mieux comprendre et traiter les cancers du sang. Par exemple, les leucémies myéloïdes, qui frappent surtout les personnes âgées, affectent les cellules sanguines myéloïdes telles que les granulocytes et les monocytes. Camargo pense que ces leucémies peuvent provenir de cellules souches sanguines, et que les leucémies chez les enfants, qui sont principalement des leucémies lymphoïdes, peuvent provenir d’eMPP.
“Nous effectuons un suivi pour essayer de comprendre les conséquences des mutations qui conduisent à la leucémie en examinant leurs effets à la fois dans les cellules souches sanguines et les eMPP chez les souris”, explique-t-il. “Nous voulons voir si les leucémies qui naissent de ces différentes cellules d’origine sont différentes – de type lymphoïde ou de type myéloïde.”
Améliorer la greffe de moelle osseuse ?
Enfin, la reconnaissance de l’existence de deux types de cellules mères dans le sang pourrait révolutionner la greffe de moelle osseuse.
” Lorsque nous avons essayé de faire des greffes de moelle osseuse chez la souris, nous avons constaté que les eMPP ne prenaient pas bien la greffe ; elles ne duraient que quelques semaines “, dit Camargo. “Si nous pouvions ajouter quelques gènes pour que les eMPP se greffent à long terme, elles pourraient…constituent potentiellement une meilleure source pour une greffe de moelle osseuse. Elles sont plus fréquentes chez les jeunes donneurs de moelle que les cellules souches sanguines, et elles sont amorcées pour produire des cellules lymphoïdes, ce qui pourrait permettre une meilleure reconstitution du système immunitaire et moins de complications infectieuses après la greffe.”
Référence : “Lifelong multilineage contribution by embryonic-born blood progenitors” par Sachin H. Patel, Constantina Christodoulou, Caleb Weinreb, Qi Yu, Edroaldo Lummertz da Rocha, Brian J. Pepe-Mooney, Sarah Bowling, Li Li, Fernando G. Osorio, George Q. Daley et Fernando D. Camargo, 15 juin 2022, Nature.
DOI: 10.1038/s41586-022-04804-z
Sachin H. Patel, MD, PhD, du Stem Cell Program (maintenant à l’Université de Californie San Francisco) et Constantina Christodoulou, PhD (maintenant à Bristol Myers Squibb) étaient les co-premiers auteurs de l’article. L’étude a été financée par les National Institutes of Health (HL128850-01A1, P01HL13147), la Evans MDS Foundation, la Alex Lemonade Foundation, la Leukemia and Lymphoma Society et le Howard Hughes Medical Institute. Les auteurs ne déclarent pas d’intérêts concurrents.