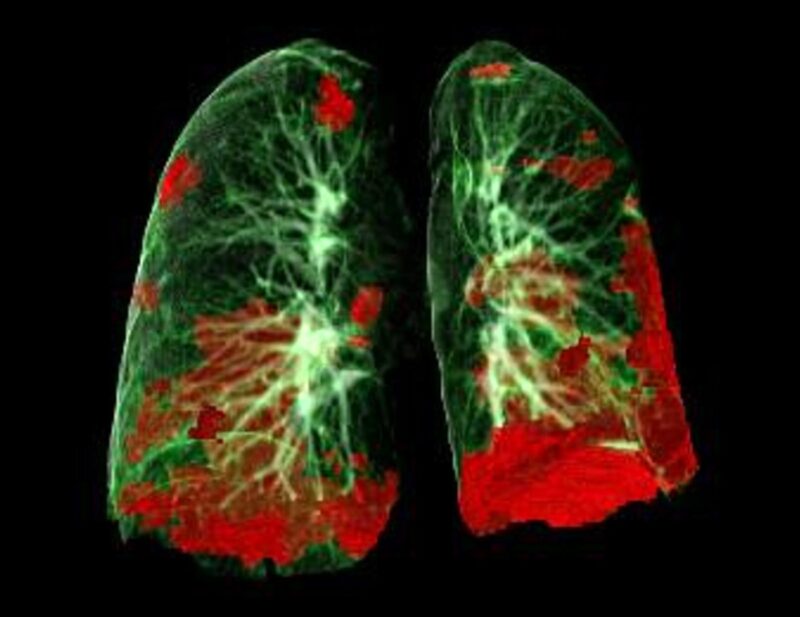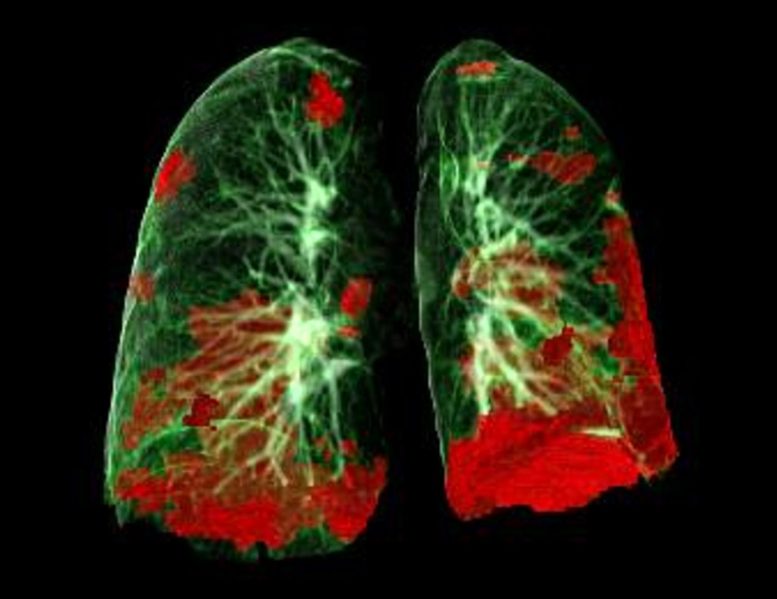
CT scan des poumons du patient montrant les dommages du COVID-19 en rouge. Crédit : Gerlig Widmann et équipe, Département de radiologie, Université médicale d’Innsbruck
Le SRAS-CoV-2 empêche la réparation et la régénération des tissus pulmonaires.
Autopsie pulmonaire et plasma échantillons de personnes décédées de COVID-19[feminine ont fourni une image plus claire de la façon dont le SRAS-CoV-2 le virus se propage et endommage les tissus pulmonaires. Les scientifiques des National Institutes of Health et leurs collaborateurs disent que les informations, publiées dans Médecine translationnelle scientifique, pourrait aider à prédire les cas graves et prolongés de COVID-19, en particulier chez les personnes à haut risque, et éclairer les traitements efficaces.
Bien que l’étude soit de petite taille (échantillons pulmonaires de 18 cas et échantillons de plasma de six de ces cas), les scientifiques affirment que leurs données ont révélé des tendances qui pourraient aider à développer de nouvelles thérapies COVID-19 et à affiner le moment d’utiliser les thérapies existantes à différents stades de la maladie progression. Les résultats incluent des détails sur la façon dont le SRAS-CoV-2, le virus qui cause le COVID-19, se propage dans les poumons, manipule le système immunitaire, provoque une thrombose généralisée qui ne se résout pas et cible les voies de signalisation qui favorisent l’insuffisance pulmonaire, la fibrose et altèrent réparation des tissus. Les chercheurs affirment que les données sont particulièrement pertinentes pour les soins aux patients COVID-19 qui sont âgés, obèses ou diabétiques, tous considérés comme des populations à haut risque pour les cas graves. Les échantillons de l’étude provenaient de patients qui présentaient au moins une affection à haut risque.
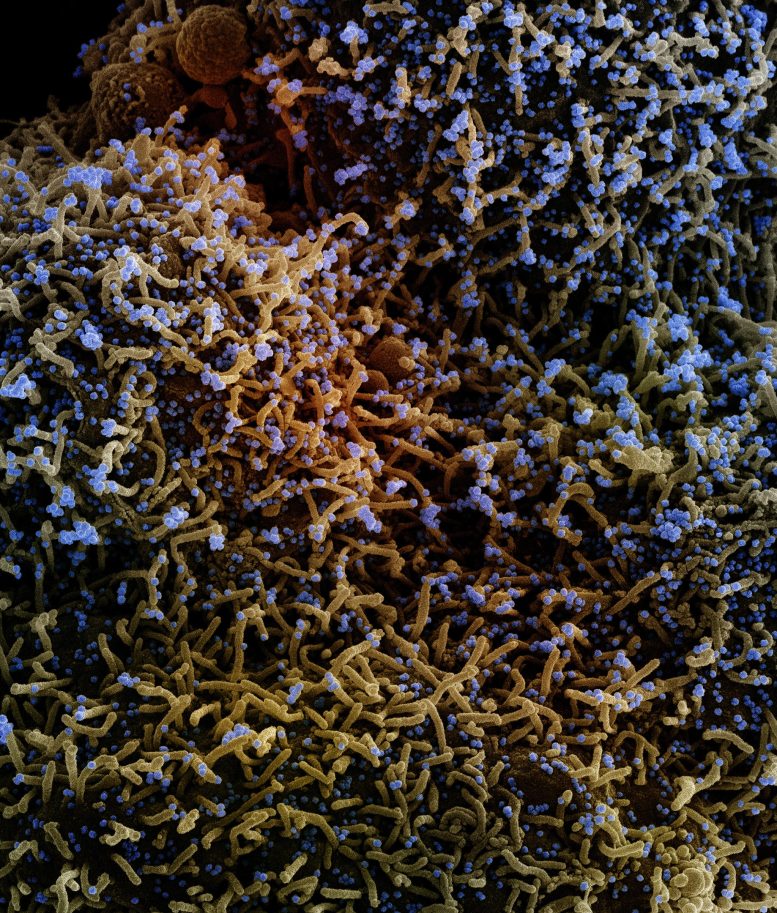
Micrographie électronique à balayage colorisée d’une cellule infectée par une souche variante de particules virales du SRAS-CoV-2 (bleu), isolée d’un échantillon de patient. Image capturée au NIAID Integrated Research Facility (IRF) à Fort Detrick, Maryland. Crédit : NIAID
L’étude a inclus des patients décédés entre mars et juillet 2020, l’heure du décès allant de trois à 47 jours après le début des symptômes. Ce calendrier varié a permis aux scientifiques de comparer les cas à court, moyen et long terme. Chaque cas a montré des résultats compatibles avec des lésions alvéolaires diffuses, qui empêchent un bon flux d’oxygène dans le sang et finissent par épaissir et raidir les poumons.
Ils ont également découvert que le SRAS-CoV-2 infectait directement les cellules épithéliales basales dans les poumons, entravant leur fonction essentielle de réparation des voies respiratoires et des poumons endommagés et de génération de tissus sains. Le processus est différent de la façon dont les virus de la grippe attaquent les cellules des poumons. Cela fournit aux scientifiques des informations supplémentaires à utiliser lors de l’évaluation ou du développement de thérapies antivirales.
Des chercheurs de l’Institut national des allergies et des maladies infectieuses du NIH ont dirigé le projet en collaboration avec l’Institut national d’imagerie biomédicale et de bioingénierie et la Food and Drug Administration des États-Unis. Parmi les autres collaborateurs figuraient l’Institute for Systems Biology de Seattle ; Université de l’Illinois, Champaign; Saint John’s Cancer Institute à Santa Monica, Californie.; les USC École de médecine Keck à Los Angeles ; Université de Washington Centre médical Harborview, Seattle; Centre médical de l’Université du Vermont, Burlington; et le Memorial Sloan Kettering Cancer Center à New York.
Référence : « Dégâts épithéliaux et endothéliaux pulmonaires, perte de réparation tissulaire, inhibition de la fibrinolyse et sénescence cellulaire dans le COVID-19 fatal » par Felice D’Agnillo, Kathie-Anne Walters, Yongli Xiao, Zong-Mei Sheng, Kelsey Scherler, Jaekeun Park, Sebastian Gygli, Luz Angela Rosas, Kaitlyn Sadtler, Heather Kalish, Charles A. Blatti, Ruoqing Zhu, Lisa Gatzke, Colleen Bushell, Matthew J. Memoli, Steven J. O’Day, Trevan D. Fischer, Terese C. Hammond , Raymond C. Lee, J. Christian Cash, Matthew E. Powers, Grant E. O’Keefe, Kelly J. Butnor, Amy V. Rapkiewicz, William D. Travis, Scott P. Layne, John C. Kash et Jeffery K Taubenberger, le 14 octobre 2021, Science Médecine translationnelle.
DOI : 10.1126 / scitranslmed.abj7790
Jeffrey Taubenberger, MD, Ph.D., chef de la section Pathogenèse et évolution virale du Laboratoire des maladies infectieuses du NIAID, est disponible pour discuter de cette étude.