Des chercheurs ont démontré qu’un certain stress peut être bénéfique pour les cellules, en découvrant un nouveau mécanisme qui pourrait aider à prévenir l’accumulation d’enchevêtrements de protéines, fréquemment observés dans le cerveau des personnes atteintes de démence.
Il est communément admis qu’un peu de stress peut être bénéfique pour nous. Les scientifiques viennent de démontrer qu’il en va de même pour les cellules, en mettant en évidence un mécanisme récemment découvert qui pourrait contribuer à prévenir l’accumulation d’enchevêtrements de protéines fréquemment observés dans la démence.
Une caractéristique de maladies telles que Alzheimer’s and Parkinson’s – collectively known as neurodegenerative diseases – is the build-up of misfolded proteins. These proteins, such as amyloid and tau in Alzheimer’s disease, form ‘aggregates’ that can cause irreversible damage to nerve cells in the brain.
Protein folding is a natural process in the body, and in healthy people, cells perform quality control to ensure that proteins are appropriately folded and misfolded proteins are eliminated. However, in neurodegenerative diseases, this system becomes impaired, which can have disastrous implications.
As the global population ages, an increasing number of people are being diagnosed with dementia, making the search for effective drugs ever more urgent. However, progress has been slow, with no medicines yet available that can prevent or remove the build-up of aggregates.
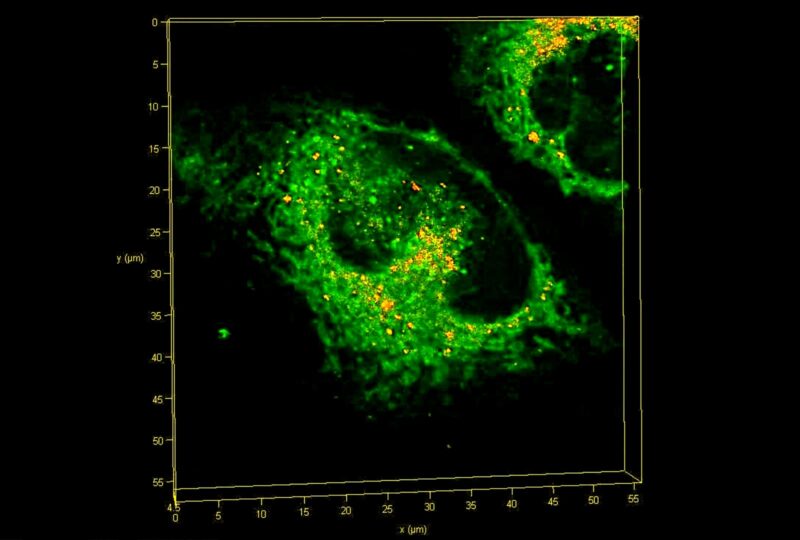
Reconstruction 3D haute résolution de la sonde d’agrégation localisée dans le RE d’une cellule vivante, vue sous un microscope à balayage laser. La lumière émise par la sonde est codée par carte thermique en fonction de sa durée de vie de fluorescence. Les agrégats sont évidents car ils ont une durée de vie plus longue, ce qui les fait apparaître en jaune-rouge sur fond de durée de vie normale courte, qui apparaît en vert. Crédit : Edward Avezov/Université de Cambridge
Dans une étude publiée aujourd’hui (6 mai 2022) dans le journal Nature Communicationsune équipe dirigée par des scientifiques du UK Dementia Research Institute de l’Université de Cambridge a identifié un nouveau mécanisme qui semble inverser l’accumulation d’agrégats, non pas en les éliminant complètement, mais plutôt en les “repliant”.
Tout comme lorsque nous sommes stressés par une charge de travail importante, les cellules peuvent être “stressées” lorsqu’elles sont appelées à produire une grande quantité de protéines”, explique le Dr Edward Avezov, de l’Institut britannique de recherche sur la démence de l’Université de Cambridge.
“Il y a de nombreuses raisons pour lesquelles cela peut être le cas, par exemple lorsqu’ils produisent des anticorps en réponse à une infection. Nous nous sommes concentrés sur le stress d’un composant des cellules connu sous le nom de réticulum endoplasmique, qui est responsable de la production d’environ un tiers de nos protéines – et nous avons supposé que ce stress pourrait provoquer un mauvais repliement.”
Le réticulum endoplasmique (RE) est une structure membranaire présente dans les cellules des mammifères. Il remplit un certain nombre de fonctions importantes, notamment la synthèse, le repliement, la modification et le transport des protéines nécessaires à la surface ou à l’extérieur de la cellule. Le Dr Avezov et ses collègues ont émis l’hypothèse que le stress subi par le RE pourrait entraîner un mauvais repliement et une agrégation des protéines en diminuant sa capacité à fonctionner correctement, ce qui conduirait à une agrégation accrue.
Ils ont été surpris de découvrir que le contraire était vrai.
“Nous avons été étonnés de constater que le fait de stresser la cellule éliminait en fait les agrégats – non pas en les dégradant ou en les éliminant, mais en démêlant les agrégats, ce qui leur permet potentiellement de se replier correctement”, a déclaré le Dr Avezov.
“Si nous pouvons trouver un moyen de réveiller ce mécanisme sans stresser les cellules – ce qui pourrait causer plus de dommages que de bien – alors nous pourrions trouver un moyen de traiter certaines démences.”
Le principal composant de ce mécanisme semble être l’une des protéines d’une classe connue sous le nom de protéines de choc thermique (HSP), dont un plus grand nombre est fabriqué lorsque les cellules sont exposées à des températures supérieures à leur température de croissance normale, et en réponse au stress.
Le Dr Avezov pense que cela pourrait contribuer à expliquer l’une des observations les plus inhabituelles dans le domaine de la recherche sur la démence. “Certaines études menées récemment dans les pays scandinaves sur des personnes qui utilisent régulièrement des saunas suggèrent qu’elles auraient moins de risques de développer une démence. L’une des explications possibles est que ce stress léger déclenche une activité plus élevée des HSP, qui aident à corriger les protéines enchevêtrées.”
L’un des facteurs qui a précédemment entravé ce domaine de recherche a été l’incapacité de visualiser ces processus dans des cellules vivantes. En collaboration avec des équipes de l’université d’État de Pennsylvanie et de l’université d’Algarve, l’équipe a mis au point une technique qui lui permet de détecter les mauvais repliements de protéines dans des cellules vivantes. Elle s’appuie sur la mesure des motifs lumineux d’un produit chimique incandescent sur une échelle de nanosecondes – un milliardième de seconde.
“C’estIl est fascinant de voir comment la mesure de la durée de vie de la fluorescence de notre sonde à l’échelle de la nanoseconde sous un microscope alimenté par laser rend évidents les agrégats autrement invisibles à l’intérieur de la cellule”, a déclaré le professeur Eduardo Melo, l’un des principaux auteurs, de l’université d’Algarve, au Portugal.
Référence : “Stress-induced protein disaggregation in the Endoplasmic Reticulum catalysed by BiP” par Melo, EP, et al. 6 mai 2022, Nature Communications.
DOI: 10.1038/s41467-022-30238-2
La recherche a été soutenue par le UK Dementia Research Institute, qui reçoit son financement du Medical Research Council, de l’Alzheimer’s Society et de l’Alzheimer’s Research UK, ainsi que de la Fondation portugaise pour la science et la technologie.