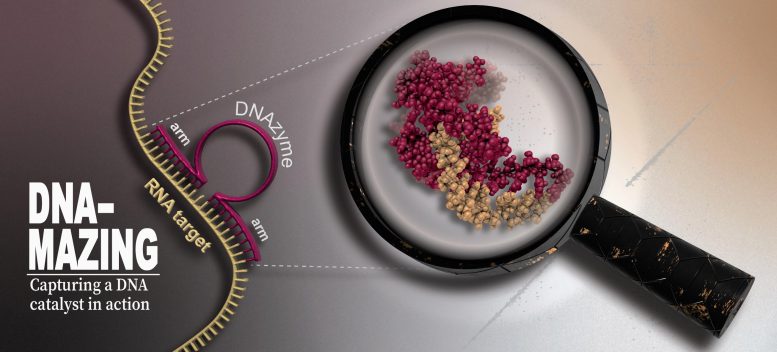
Un DNAzyme (rouge) utilise ses bras de liaison pour s’arrimer à un emplacement spécifique sur un brin d’ARN (jaune), puis le clive en son noyau. La RMN en temps réel à haute résolution, la résonance paramagnétique électronique et la spectroscopie de fluorescence, ainsi que des simulations de dynamique moléculaire ont été utilisées pour identifier la structure et les mécanismes catalytiques de l’ADNzyme. Crédit : HHU/Manuel Etzkorn
Les DNAzymes sont des biocatalyseurs de précision qui détruisent les indésirables ARN molécules. Cependant, des obstacles majeurs à leur utilisation en médecine demeurent. En collaboration avec le Jülich Research Center (FZJ) et l’Université de Bonn, une équipe de recherche de l’Université Heinrich Heine de Düsseldorf (HHU) a étudié avec une résolution atomique comment les DNAzymes fonctionnent en temps réel. Ils ont maintenant présenté ces découvertes fondamentales importantes et leur application dans la célèbre revue La nature.
DNAzymes – un mot composé de ADN et enzyme – sont des séquences d’ADN catalytiquement actives. Ils comprennent un noyau catalytique comprenant une quinzaine d’acides nucléiques flanqués à droite et à gauche de courts bras de liaison, chacun d’une dizaine d’acides nucléiques. Alors que la séquence du noyau est fixée, les bras de liaison peuvent être modifiés pour correspondre spécifiquement à pratiquement n’importe quelle séquence cible d’ARN.
L’objectif est de cibler les molécules d’ARN indésirables des virus, du cancer ou des cellules nerveuses endommagées, en utilisant des ADNzymes pour les attaquer et les détruire. Ceci est réalisé via des séquences de liaison qui correspondent à une séquence de nucléotides sur la molécule d’ARN ciblée. Le DNAzyme s’arrime précisément à la position correspondante et le noyau clive la molécule d’ARN, dont les fragments sont ensuite rapidement dégradés dans la cellule. Les bras de reliure peuvent être remplacés rapidement et facilement.
Les avantages thérapeutiques sont évidents : l’ARN indésirable peut être détruit avec précision, tandis que d’autres brins d’ARN utiles dans une cellule restent intacts. Dans certains virus comme le SRAS-CoV2 et Ebola, le matériel génétique est codé sur une molécule d’ARN. Comme les cellules saines, les cellules cancéreuses utilisent ce qu’on appelle l’ARN messager (ARNm) pour copier les plans des protéines à partir de leur ADN et les transférer vers les usines de molécules. La séquence d’ARNm dans les cellules cancéreuses est souvent légèrement différente de celle des cellules saines ou présente en différentes quantités, ce qui signifie que les ADNzymes peuvent attaquer spécifiquement les cellules cancéreuses tout en épargnant les autres.
“Ce qui semble exceptionnel en théorie et a déjà été proposé il y a 20 ans, ne fonctionne malheureusement pas comme ça dans la pratique médicale”, déclare le Dr Manuel Etzkorn, chef de groupe de travail à l’Institut de biologie physique HHU et dernier auteur de l’étude, qui est maintenant publié dans La nature. « Dans un tube à essai, les DNAzymes sont très efficaces pour détruire les molécules d’ARN, mais cela se produit rarement dans une cellule. Il doit y avoir un processus concurrent qui bloque les ADNzymes. Cependant, sans une compréhension fondamentale de leur fonctionnement, il est très difficile de développer des variantes améliorées de DNAzyme qui peuvent accomplir leur travail dans les cellules. Nos connaissances ont maintenant apporté un mouvement dans cette situation de blocage. »
Dans leur étude, les auteurs du HHU et une équipe du Jülich Research Center (FZJ), de l’Université de Bonn et d’une entreprise suisse ont cherché à comprendre comment le système dans son ensemble fonctionne de manière dynamique, quelles étapes se produisent dans le processus de liaison et de clivage et quelles sont les les cofacteurs soutiennent la réaction.
Les chercheurs ont observé les processus à une résolution atomique et en partie en temps réel à l’aide de la spectroscopie de résonance magnétique nucléaire (RMN) à haute résolution. Cela leur a permis de décrire l’arrangement atomique tridimensionnel supposé par l’ADNzyme pour se lier à l’ARN et le cliver : le noyau s’enroule autour du brin d’ARN de manière très efficace, le clivant en deux morceaux en plusieurs étapes intermédiaires. Après le clivage, l’ADNzyme libère les fragments et peut se lier à nouveau ailleurs.
Le professeur Holger Gohlke de la chaire HHU de chimie pharmaceutique et médicinale et de l’Institut des biosciences et des géosciences du FZJ, dont l’équipe a mené des simulations de dynamique moléculaire sur le complexe DNAzyme/RNA, ajoute : « Dans le meilleur sens de la modélisation intégrative, nous ont pu mettre en avant un mécanisme de clivage de l’ARN plausible au niveau atomique et fournir des informations sur la préférence des bases d’ARN au site de clivage.
Jan Borggräfe, doctorant dans le groupe de travail d’Etzkorn et auteur principal de l’étude, explique pourquoi les DNAzymes ne fonctionnent pas bien dans les cellules : « Nous avons établi que le magnésium, en tant que cofacteur clé, joue divers rôles essentiels dans le mécanisme, mais qu’il se lie relativement mal et seulement brièvement au DNAzyme. Il y a d’autres composants dans la cellule avec une plus grande affinité pour le magnésium qui « volent » le magnésium de l’ADNzyme pour ainsi dire.
La prochaine étape consiste à mener des enquêtes structurelles sur les cultures cellulaires et les organoïdes. L’objectif pour les applications thérapeutiques est d’améliorer l’affinité magnésienne des ADNzymes par des modifications ciblées afin d’augmenter leur activité dans les tissus biologiques.
Le Dr Etzkorn mentionne un autre domaine d’application : « L’objectif de notre institut est la recherche sur les maladies neurodégénératives, où nous voyons également un bon potentiel pour les ADNzymes. Dans le cas de la maladie de Parkinson, ils peuvent dans certaines circonstances être capables de détruire la séquence d’ARNm qui pilote la production d’alpha-synucléine qui, en grande quantité, peut favoriser des processus neurotoxiques. Les ADNzymes pourraient également donner naissance à une nouvelle classe d’antibiotiques.
Le professeur Dr. Dieter Willbold, directeur de l’Institut de biologie physique HHU et de l’Institut FZJ de biochimie structurale, ajoute : « L’étude est un autre exemple de la façon dont la recherche fondamentale en biologie structurale peut apporter des contributions essentielles aux avancées biomédicales révolutionnaires. Le nouveau fleuron du centre RMN biomoléculaire, un appareil RMN 1,2 GHz, a déjà contribué à ce succès. L’appareil du centre de RMN biomoléculaire, qui est exploité conjointement par HHU et FZJ, est l’un des systèmes les plus puissants au monde et fournit des informations uniques sur la structure et le fonctionnement des éléments constitutifs de la vie. Un court film documentaire sur l’installation complexe de l’appareil est disponible ci-dessous :
Référence : « Analyse structurelle résolue en temps d’un catalyseur d’ADN cleaving d’ARN » par Jan Borggräfe, Julian Victor, Hannah Rosenbach, Aldino Viegas, Christoph GW Gertzen, Christine Wuebben, Helena Kovacs, Mohanraj Gopalswamy, Detlev Riesner, Gerhard Steger, Olav Schiemann , Holger Gohlke, Ingrid Span et Manuel Etzkorn, 23 décembre 2021, La nature.
DOI : 10.1038 / s41586-021-04225-4