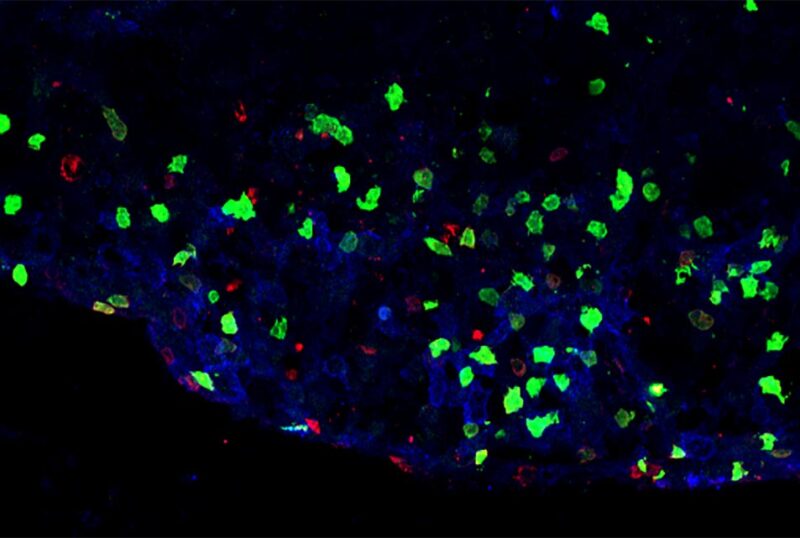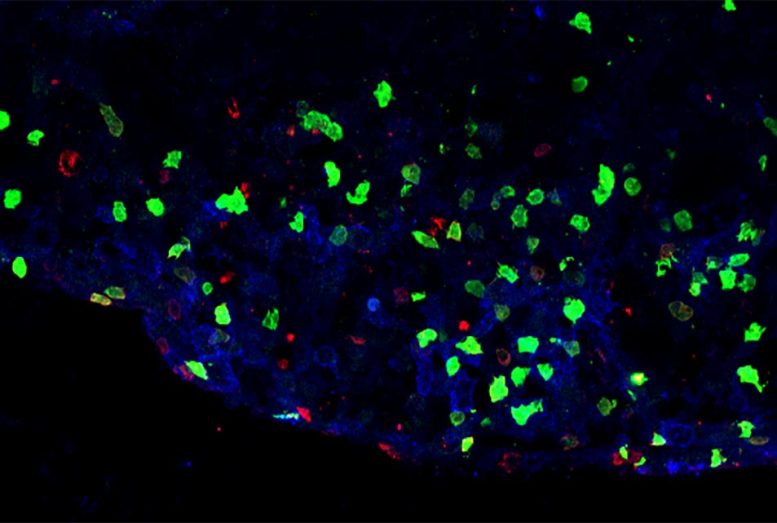
Lésion inflammatoire de la moelle épinière d’un modèle murin de sclérose en plaques démontrant la présence d’ILC3 (vert) ou de lymphocytes T (rouge). Crédit : Image reproduite avec l’aimable autorisation du Dr Christopher N. Parkhurst
Un groupe de cellules immunitaires qui protègent normalement contre l’inflammation dans le tractus gastro-intestinal peut avoir l’effet inverse dans la sclérose en plaques (SEP) et d’autres affections liées à l’inflammation cérébrale, selon une nouvelle étude menée par Weill Cornell Medicine et des chercheurs NewYork-Presbyterian. Les résultats suggèrent que contrer l’activité de ces cellules pourrait être une nouvelle approche thérapeutique pour de telles conditions.
Les chercheurs, qui ont rendu compte de leurs découvertes le 1er décembre 2021, dans la revue La nature, étudiaient un ensemble de cellules immunitaires appelées cellules lymphoïdes innées du groupe 3 (ILC3), qui aident le système immunitaire à tolérer les microbes bénéfiques et à supprimer l’inflammation dans les intestins et d’autres organes dans tout le corps. Ils ont découvert un sous-ensemble unique de ces ILC3 qui circulent dans la circulation sanguine et peuvent s’infiltrer dans le cerveau et, à leur grande surprise, n’éteignent pas l’inflammation mais l’allument au contraire.
Les scientifiques ont appelé ce sous-ensemble ILC3 inflammatoires et les ont trouvés dans le système nerveux central de souris atteintes d’une maladie modélisant la SEP. Au lieu de restreindre la réponse immunitaire, ce sous-ensemble d’ILC3 a incité un autre groupe de cellules immunitaires appelées cellules T à attaquer les fibres nerveuses myélinisées, entraînant des symptômes de maladie de type SEP. Les chercheurs ont détecté des ILC3 inflammatoires similaires dans le sang périphérique et le liquide céphalo-rachidien de patients atteints de SEP.
“Ce travail a le potentiel d’éclairer notre compréhension et les traitements potentiels d’une grande variété d’affections impliquant une infiltration de lymphocytes T dans le cerveau”, a déclaré l’auteur principal, le Dr Gregory Sonnenberg, professeur agrégé de microbiologie et d’immunologie en médecine dans le Division de gastroentérologie et d’hépatologie et membre du Jill Roberts Institute for Research in Inflammatory Bowel Disease à Weill Cornell Medicine.
La SEP touche plus de deux millions de personnes dans le monde. D’autres affections caractérisées par une inflammation chronique du cerveau affligent des dizaines de millions d’autres et comprennent Alzheimer et les maladies de Parkinson. Il existe également des preuves que la neuroinflammation se développe naturellement avec le vieillissement et est un facteur majeur du déclin cognitif lié à l’âge, et plus récemment, les réponses inflammatoires des lymphocytes T dans le cerveau ont été liées à des symptômes neurologiques associés à SRAS-CoV-2 infection.
Les chercheurs ont montré dans des travaux récents que les ILC3 résidant dans l’intestin agissent comme des sentinelles et des régulateurs immunitaires, supprimant l’inflammation, y compris l’activité des lymphocytes T inflammatoires, et prévenant le cancer. Dans la nouvelle étude, ils ont examiné les rôles des ILC3 dans le cerveau et ont découvert, contrairement à leurs attentes, que les ILC3 ne sont normalement pas présentes dans le cerveau dans des conditions saines, mais peuvent s’infiltrer dans le cerveau à partir de la circulation sanguine pendant l’inflammation. Lorsqu’ils s’infiltrent dans le système nerveux central, ils ont des effets pro-inflammatoires plutôt qu’anti-inflammatoires.
Les chercheurs ont montré avec un modèle murin de SEP que ces ILC3 inflammatoires dans le cerveau fonctionnent comme des cellules présentatrices d’antigène : , provoquant des lésions nerveuses qui donnent lieu à des signes de maladie. Ils ont trouvé les ILC3 inflammatoires en étroite association avec les cellules T dans les régions d’inflammation active et de lésions nerveuses dans le cerveau de souris.
“L’infiltration de ces ILC3 inflammatoires dans le cerveau et la moelle épinière des souris coïncide avec le début et le pic de la maladie”, a déclaré le premier auteur John Benji Grigg, doctorant à la Weill Cornell Graduate School of Medical Sciences du laboratoire Sonnenberg. « De plus, nos données expérimentales chez la souris démontrent que ces cellules immunitaires jouent un rôle clé dans la pathogenèse de la neuro-inflammation. »
Les chercheurs ont découvert qu’ils pouvaient prévenir les maladies de type SEP chez les animaux en supprimant des ILC3 une molécule clé appelée MHCII, qui est normalement utilisée dans le processus de présentation de l’antigène. cellules.
“Malgré nos meilleurs traitements modificateurs de la maladie pour la SEP, les patients continuent de progresser et, comme la maladie apparaît tôt dans la vie, ils sont confrontés à la perspective d’un handicap physique et cognitif permanent”, a déclaré le co-auteur, le Dr Tim Vartanian, professeur de neurosciences. au Feil Family Brain and Mind Institute de Weill Cornell Medicine, chef de la division de la sclérose en plaques et de la neuro-immunologie et professeur de neurologie au département de neurologie de Weill Cornell Medicine et du NewYork-Presbyterian/Weill Cornell Medical Center. “L’identification des ILC3 inflammatoires avec des capacités de présentation d’antigène dans le système nerveux central des personnes atteintes de SEP offre une nouvelle cible stratégique pour prévenir les lésions du système nerveux.”
Enfin, les chercheurs ont découvert que les ILC3 qui résident dans d’autres tissus du corps peuvent être programmées, en effet, pour contrer l’activité des cellules T infiltrant le cerveau, empêchant ainsi la maladie de type SEP chez la souris.
Ce travail a été réalisé en étroite collaboration avec le Dr Ari Waisman, directeur de l’Institut de médecine moléculaire du Centre médical universitaire de l’Université Johannes Gutenberg de Mayence, où les chercheurs se sont appuyés sur des recherches antérieures démontrant qu’il existe des ILC3 résidant dans l’intestin qui affichent des antigènes pour Les cellules T d’une manière légèrement différente pour favoriser l’inactivité des cellules T, ou « la tolérance ». Les chercheurs ont démontré qu’en exposant expérimentalement ces ILC3 intestinales induisant une tolérance à la myéline, ils pouvaient bloquer l’activité neuro-inflammatoire des cellules T et le développement d’une maladie de type SEP chez la souris.
Les travaux indiquent donc la possibilité que la SEP et potentiellement de nombreuses autres affections inflammatoires puissent un jour être traitées soit en inhibant directement l’activité des ILC3 inflammatoires qui infiltrent le cerveau, soit en ciblant des auto-antigènes vers les ILC3 intestinales qui favorisent la tolérance dans d’autres tissus, dit le Dr Sonnenberg.
Référence : « Antigen-presenting innate lymphoid cells orchestrant neuroinflammation » par John B. Grigg, Arthi Shanmugavadivu, Tommy Regen, Christopher N. Parkhurst, Anees Ahmed, Ann M. Joseph, Michael Mazzucco, Konrad Gronke, Andreas Diefenbach, Gerard Eberl, Timothy Vartanian, Ari Waisman et Gregory F. Sonnenberg, 1er décembre 2021, La nature.
DOI : 10.1038 / s41586-021-04136-4
Le laboratoire Sonnenberg est soutenu par les National Institutes of Health (R01AI143842, R01AI123368, R01AI145989, R01AI162936, R21CA249284 et U01AI095608), la NIAID Mucosal Immunology Studies Team (MIST), la Crohn’s and Colitis Foundation, la Searle Scholars Foundation, l’American Asthma Bourse d’études, financement de projet pilote du Center for Advanced Digestive Care (CADC), bourse d’investigateurs dans la pathogenèse des maladies infectieuses du Burroughs Wellcome Fund, bourse Wade FB Thompson/Cancer Research Institute (CRI) CLIP Investigator, Meyer Cancer Centre Collaborative Research Initiative, la Dalton Family Foundation, Linda et Glenn Greenberg et le Roberts Institute for Research in IBD. Gregory F. Sonnenberg est un CRI Lloyd J. Old STAR. John Benji Grigg est soutenu par l’Institut national des allergies et des maladies infectieuses des Instituts nationaux de la santé sous le numéro d’attribution F31AI138389-01A1. Le soutien à l’acquisition d’échantillons humains via la banque de cellules vivantes JRI IBD est fourni par le JRI, le Jill Roberts Center for IBD, Cure for IBD, la Fondation Rosanne H. Silbermann et la division Weill Cornell Medicine de gastroentérologie et nutrition pédiatriques.