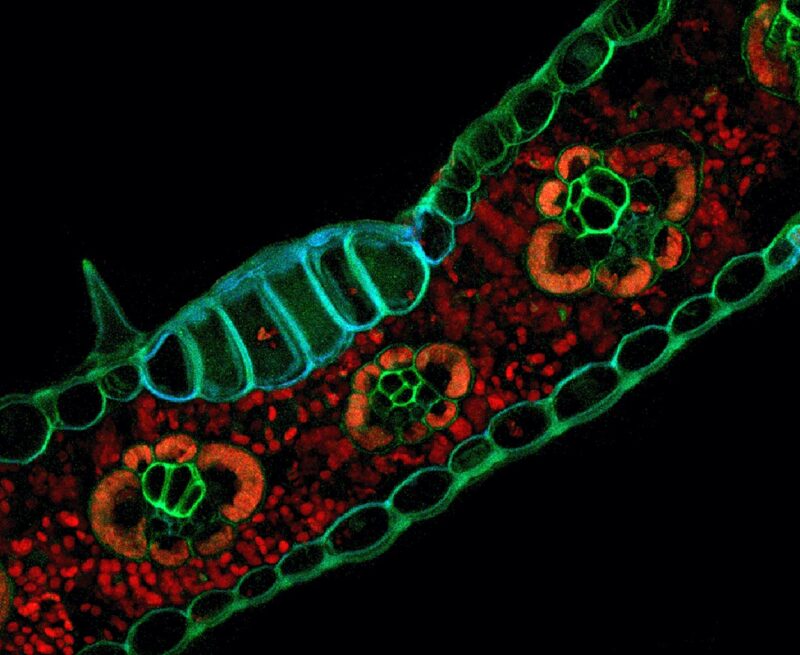
La fixation du formaldéhyde améliore les modèles de fluorescence des tissus dans les sections transversales des feuilles de maïs (Zea mays). Le traitement avec une solution de fixateur de paraformaldéhyde a révélé une fluorescence bleue/verte distinctive de l’épiderme, des trichomes, du xylème, du phloème et des cellules bulliformes résultant de la fluorescence induite par l’aldéhyde. Par comparaison, une autofluorescence rouge de la chlorophylle a été observée dans les cellules de la gaine des faisceaux et le mésophylle des sections transversales des feuilles. Cet échantillon a été préparé en utilisant une technique de fixation au formaldéhyde et d’imagerie confocale décrite par Pegg et al. dans « Algae to Angiosperms : Autofluorescence for rapid visualization of plant anatomy Among divers taxa » dans ce numéro. La fixation au formaldéhyde d’échantillons de taxons de Viridiplantae tels que Zea mays génère des données structurelles utiles tout en ne nécessitant aucune coloration ou compensation histologique supplémentaire. De plus, l’acquisition d’images ne nécessite qu’un équipement spécialisé minimal sous la forme de microscopes capables de fluorescence. Crédit : Timothy J. Pegg
Les scientifiques ont parcouru un long chemin depuis qu’Antonie van Leeuwenhoek a découvert des colonies grouillantes de bactéries et de protozoaires auparavant invisibles en regardant à travers ses microscopes sur mesure. L’architecture des cellules, des organites, des protéines et même des molécules a depuis été éclairée à travers l’arbre de la vie. Pourtant, malgré ces avancées, des obstacles subsistent pour cartographier de manière exhaustive le monde microscopique. Avant de pouvoir être observés au microscope, les tissus et les composants cellulaires doivent d’abord être colorés avec des colorants et des fixateurs et soumis à un long processus de préparation.
Dans une nouvelle étude publiée dans la revue Applications en sciences végétales, les scientifiques évitent le besoin de coloration des spécimens en exploitant l’autofluorescence naturelle des tissus des espèces à travers l’arbre de vie de la plante.
“Notre travail fournit un protocole généralisé et rentable pour la préparation et la visualisation d’échantillons de plantes qui est également applicable aux grands instituts de recherche et aux petits groupes de sciences végétales”, a déclaré le Dr Timothy Pegg, professeur adjoint invité au Marietta College et auteur principal de la étudier.
Lorsque certains types de tissus chez les plantes et les animaux absorbent la lumière, les électrons de leurs atomes reçoivent une décharge d’énergie qui les propulse dans un état excité. Dans les feuilles des plantes, ces électrons deviennent si instables qu’ils se libèrent de leurs atomes et sont utilisés par la plante pour alimenter la photosynthèse. Dans d’autres tissus, l’énergie excédentaire est réémise sous forme de lumière basse fréquence suffisamment brillante pour être détectée avec des microscopes spécialisés.
L’autofluorescence n’a pas toujours été considérée comme une bonne chose. Dans les cas où les chercheurs doivent utiliser des colorants pour visualiser des structures spécifiques, les propriétés d’émission de lumière des tissus voisins peuvent interférer en diminuant le contraste entre les différents types de cellules.
Mais il peut aussi être une ressource indispensable pour la découverte. L’autofluorescence a été utilisée pour détecter les cancers à début précoce, ainsi que d’autres maladies et pathologies. Il a été utilisé pour étudier comment les insectes utilisent leur langue et leurs antennes pour goûter la nourriture, les mécanismes sous-jacents à la régénération de la queue des lézards et pour analyser la diversité du plancton microscopique dans les environnements marins.
L’autofluorescence est également utile dans les plantes, où elle apparaît dans tout, des tissus durs qui confèrent aux plantes ligneuses leur stabilité, aux résidus absorbant l’eau recouvrant les spores et le pollen, en passant par l’arsenal diversifié de composés toxiques que les plantes produisent pour éloigner les potentiels. prédateurs.
Jusqu’à présent, cependant, les chercheurs n’avaient pas de protocole unique pour détecter la lumière autofluorescente dans les plantes. L’absence d’une approche standard unifiée est compréhensible, étant donné qu’il existe près d’un demi-million d’espèces vivantes de plantes terrestres et d’algues, mais Pegg et ses collègues ne sont pas découragés. Ils ont sélectionné 12 espèces de plusieurs groupes de plantes clés séparés par plus de 500 millions d’années d’histoire évolutive, notamment des pins, des bryophytes, des plantes à fleurs et des algues.
À l’aide de ces représentants, ils ont développé une méthode rentable de préservation des tissus sans avoir besoin de taches ou de colorants.
Alors que l’autofluorescence peut souvent être visualisée directement avec des microscopes confocaux, elle peut également être induite ou améliorée avec différents fixateurs, notamment des alcools, de l’éthanol et des composés appelés aldéhydes. Pegg et ses collègues ont choisi cinq des plus efficaces parmi ceux-ci pour tester leurs spécimens de plantes. Après avoir mariné dans un fixateur pendant 24 heures, les plantes ont été rincées, coupées à la largeur d’un cheveu humain et montées sur une lame transparente pour la visualisation.
Lorsque les chercheurs ont regardé au microscope, le monde miniature des cellules végétales et des organites a été mis en évidence. Les lignes rigides des parois cellulaires se détachaient en bas-relief de la chlorophylle étroitement tassée à l’intérieur. En se concentrant sur des longueurs d’onde particulières de la lumière émise par les protéines, ils ont pu faire la distinction entre les caractéristiques denses des noyaux et les tissus conducteurs d’eau et de sucre qui serpentent entre les cellules.
La plupart des fixateurs se sont bien comportés dans les plantes représentatives, avec des résultats frappants, mais les algues se sont avérées être une exception. La plupart des plantes terrestres ont des parois cellulaires épaisses et renforcées qui aident à prévenir la perte d’eau tout en fournissant un support structurel, des qualités qui manquent aux algues. En raison de leur échafaudage cellulaire plus fragile, les fixateurs à l’éthanol et à l’alcool ont rapidement pénétré les parois cellulaires des algues et de la seule hépatique (une plante étroitement liée aux mousses) utilisées dans l’étude, provoquant le froissement et la déformation des organites. Pour ces échantillons, Pegg recommande de s’en tenir aux fixateurs d’aldéhyde ou de réduire le temps utilisé dans les étapes de préparation des échantillons.
La plupart des laboratoires de recherche ne possèdent pas non plus les microscopes confocaux haute puissance nécessaires pour visualiser les structures cellulaires à des échelles fines, mais paient plutôt des taux horaires pour utiliser l’équipement fourni par leur institution, un problème que Pegg et ses collègues espèrent que leur protocole pourra résoudre.
“Notre technique simple de préparation d’échantillons peut réduire le temps que les chercheurs doivent passer à visualiser des échantillons sur des microscopes avancés”, a déclaré le Dr Robert Baker, professeur adjoint de biologie à l’Université de Miami et auteur principal de l’étude.
Tous les produits chimiques et réactifs utilisés dans l’étude sont également peu coûteux et facilement disponibles, ce qui signifie qu’à peu près n’importe qui dans un institut de recherche peut utiliser ce protocole pour étudier les interactions subcellulaires dans les plantes.
Référence : « Algae to angiosperms : Autofluorescence for rapid visualization of plant anatomy between diverse taxa » par Timothy J. Pegg, Daniel K. Gladish et Robert L. Baker, 2 juillet 2021, Applications en sciences végétales.
DOI : 10.1002 / aps3.11437