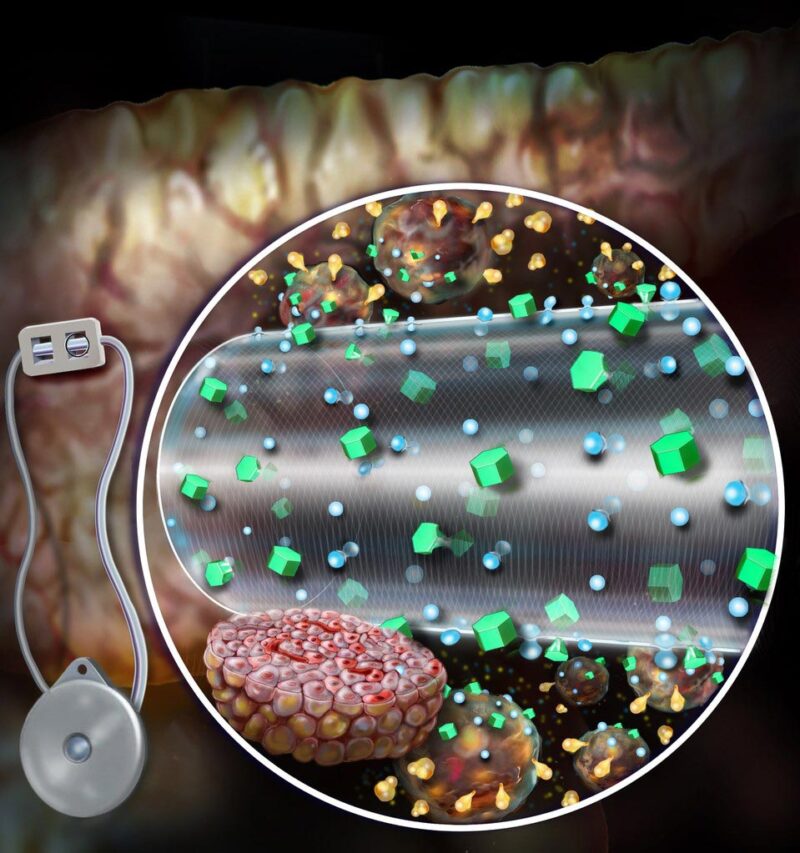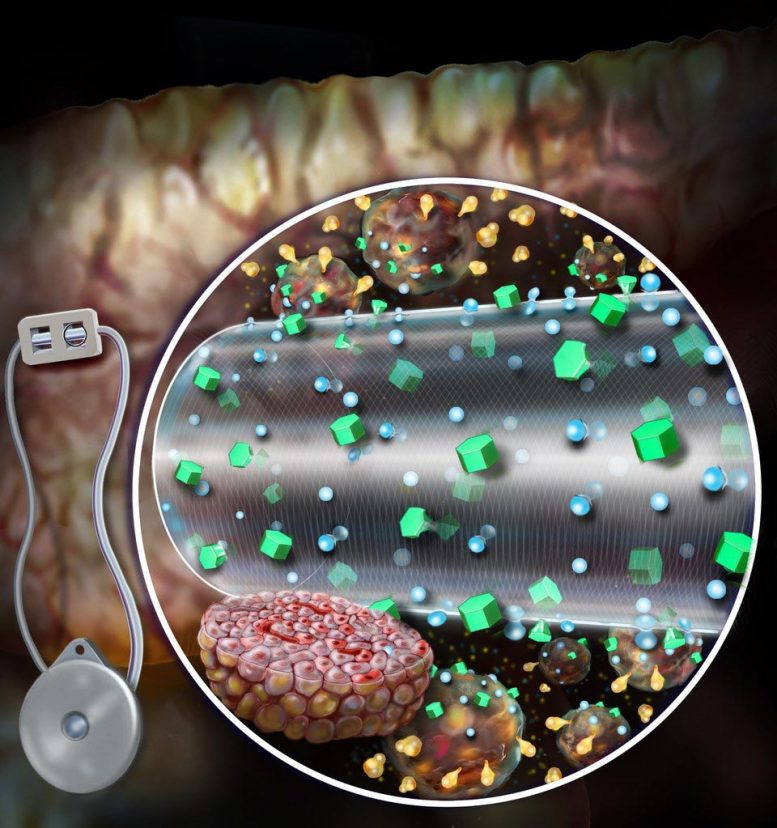
Le gadget d’encapsulation amélioré par convection, comme illustré, améliore le transport des nutriments, ce qui améliore la survie et améliore la sécrétion d’insuline réceptive au glucose à partir du tissu bêta greffé. Crédit : Randal McKenzie
Les bio-ingénieurs de Brigham nous proposent un dispositif de macroencapsulation amélioré par convection qui offre le potentiel d’un traitement plus rapide et plus efficace pour les personnes atteintes de diabète de type 1.
Plus de quarante millions de personnes dans le monde sont touchées par le diabète de type 1 (DT1), une bonne maladie auto-immune par laquelle les cellules β productrices d’insuline dans le pancréas sont généralement détruites par les mécanismes de défense. Aujourd’hui, il existe plusieurs options de traitement toutes nouvelles et émergentes pour le diabète de type 1, y compris les dispositifs de macroencapsulation (MED) – des compartiments conçus pour abriter et protéger les cellules sécrétrices d’insuline. Comme une armure en ce qui concerne le chevalier, les médicaments protègent les cellules à l’intérieur contre les agressions (du système immunitaire du sponsor) tout en permettant aux nutriments de sortir et d’entrer afin que les cellules puissent certainement encore survivre. Mais les médicaments ont plusieurs restrictions et l’augmentation de l’utilisation de tels dispositifs avec les humains a été difficile. Une équipe associée à des chercheurs du Brigham et du Women’s Hospital en coopération avec des collègues de l’Université Harvard et de la faculté de médecine de l’Université de Ma a conçu un MED amélioré par convection (ceMED), qui pourrait baigner en continu les tissus dans les nutriments dont ils ont besoin et améliorer les cellules capacité de charge, tout en augmentant le succès cellulaire, la sensibilité au glucose et la libération d’insuline en temps opportun. Dans les versions précliniques, le ceMED a rapidement réagi aux niveaux de sucre dans le sang dans les deux jours suivant son incorporation. Les résultats sont publiés dans Les Procédures de l’Ecole Nationale des Sciences .
« Grâce aux récents progrès, nous nous rapprochons de plus en plus d’une source importante de matériel cellulaire de type qui peut répondre à la glycémie en sécrétant de l’insuline, mais le prochain problème consiste à faire pénétrer ce matériel cellulaire dans le corps de manière peu intrusif et aura une longue durée de vie avec une performance maximale », a déclaré l’auteur associé Jeff Karp, PhD, chercheur principal et titulaire d’une chaire distinguée en anesthésiologie clinique, périopératoire et médecine de la douleur. « Notre appareil a démontré une viabilité cellulaire améliorée ainsi qu’un délai minimal pour la transplantation ultérieure. C’est une puissante preuve d’idée préclinique pour ce système. ”
Les médicaments actuels dépendent de la diffusion – les nutriments se dissipent à travers la couche de membrane externe de l’appareil à l’appui d’un certain nombre de cellules peuvent recevoir des nutriments plus de l’oxygène et, par conséquent, sécréter de l’insuline. Le ceMED particulier a été conçu pour offrir des nutriments convectifs via un flux continu associé à du fluide vers les cellules illustrées, permettant à plusieurs couches de tissus de se développer et de durer. Le modèle de l’équipe comporte deux compartiments : une chambre d’équilibre (EqC) qui recueillera les nutriments dans l’environnement et une chambre cellulaire (CC) qui abritera les cellules sécurisées. L’EqC est enfermé dans du polytétrafluoroéthylène – la membrane semi-perméable avec des pores qui permettent aux fluides de pénétrer. Une membrane interne supplémentaire encerclant le CC permet de manière sélective le transport des nutriments et protège contre les réponses immunitaires. Les liquides perfusés s’écoulent à travers une fibre alimentaire creuse poreuse atteignant le CIRCUIT FERMÉ à un foyer similaire de nutriments depuis le tissu entourant l’implant particulier. La fibre creuse permet à l’insuline et au glucose de passer librement, mais ne permet pas aux molécules immunitaires cruciales, car elles pourraient attaquer les cellules encapsulées.
« L’application d’îlots dérivés de cellules d’origine pour traiter le diabète auto-immun ou de type 1 a atteint le point de trouver une méthode pour protéger les cellules pv du rejet immunitaire et maximiser leur propre survie et leur fonctionnalité après la transplantation », a déclaré co- auteur Doug Melton, PhD, du Département de biologie cellulaire et régénérative de la Harvard Stem Cell Company. « La macroencapsulation améliorée par convection pourrait être une approche viable pour atteindre tous ces objectifs. ”
Le dispositif offre de nombreux avantages par rapport aux pompes à insuline standard et permet aux cellules de sécréter de l’insuline à la demande et d’arrêter rapidement de sécréter de l’insuline lorsque la glycémie diminue. Dans des modèles animaux de diabète de type 1, le ceMED a amélioré le succès et les sécrétions d’insuline des cellules et a commencé à diminuer le taux de sucre dans le sang dès 2 jours après la transplantation.
“Le dispositif ceMED a le potentiel d’être un bon système autonome qui ne pourrait pas nécessiter un remplissage et un remplacement continus des cartouches d’insuline”, a déclaré l’auteur principal Kisuk Yang, PhD, ancien postdoctoral de nombreux autres dans le laboratoire Karp et maintenant professeur à la Division de Bio-ingénierie à l’Université nationale d’Incheon en Corée du Sud.
“En raison de sa réactivité, cette approche d’amélioration du flux de l’appareil et du livre pourrait être particulièrement utile pour les diabétiques” fragiles “, les personnes dont le diabète entraîne des fluctuations imprévues des niveaux de glucose “, a ajouté Eoin O’Cearbhaill, PhD (maintenant à l’Université de Dublin, Ireland), le co-auteur qui a contribué à développer cette idée tout en travaillant comme stagiaire postdoctoral au sein du Karp Lab. L’équipe particulière note les directions à venir qui devront être poursuivies pour amener le produit à la clinique, qui comprend l’augmentation de la capacité de charge cellulaire et l’optimisation du système de flux perfusé pour une utilisation humaine.
“Dans l’ensemble, ces résultats mettent en évidence les avantages importants de ceMED par rapport aux dispositifs actuels basés sur la diffusion, notamment un succès cellulaire amélioré, une encapsulation fibreuse réduite qui peut compromettre les fonctionnalités au fil du temps et des taux d’activation et de désactivation plus rapides destinés à la sécrétion d’insuline”, a déclaré Karp. « Cette approche a le potentiel d’améliorer le succès des traitements de remplacement des cellules β pour aider de nombreux patients atteints de DT1 et leurs proches à gérer cette maladie difficile. ”
Référence: “Un dispositif de macroencapsulation amélioré par convection réparatrice pour améliorer la stabilité des cellules et la sécrétion d’insuline” par Yang Nited royaume et ‘s. , 6 sept 2021, Actes de l’Académie nationale des sciences .
DOI : 10. 1073/pnas. 2101258118
Financement : Ce travail particulier a été soutenu par la Juvenile Diabetes Research Foundation (3-SRA-2013-282), et les National Institutes of Health (subvention R01 HL095722 plus U01DK104218), et la subvention d’analyse de l’université nationale d’Incheon en 2021.