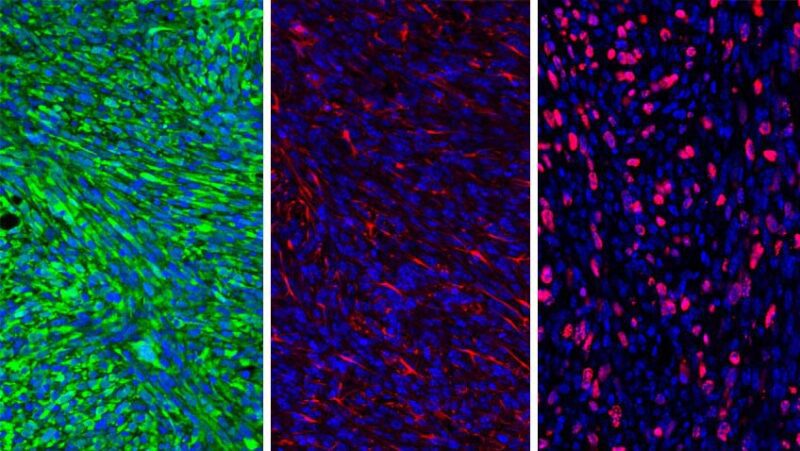
Cellules de gliome. Crédit : Centre anticancéreux Rogel de l’Université du Michigan.
Cette approche, étudiée chez la souris, permet de franchir la barrière hémato-encéphalique et de briser le bouclier que les tumeurs construisent contre la réponse immunitaire.
Lorsque les chercheurs du Rogel Cancer Center de l’Université du Michigan ont découvert une petite molécule qui bloque une voie clé dans les tumeurs cérébrales, ils ont été optimistes. Mais un problème subsistait : comment faire passer l’inhibiteur par la circulation sanguine et dans le cerveau pour atteindre la tumeur.
En collaboration avec plusieurs laboratoires, les équipes de scientifiques ont fabriqué une nanoparticule pour contenir l’inhibiteur, et les résultats ont été encore meilleurs que prévu.
Non seulement les nanoparticules ont délivré l’inhibiteur à la tumeur dans des modèles de souris, où le médicament a réussi à activer le système immunitaire pour éliminer le cancer, mais le processus a déclenché une mémoire immunitaire de sorte qu’une tumeur réintroduite a également été éliminée. C’est un signe prometteur que cette nouvelle approche potentielle pourrait non seulement traiter les tumeurs cérébrales mais aussi prévenir ou retarder les récidives.
“Personne ne pouvait faire pénétrer cette molécule dans le cerveau. C’est vraiment une étape importante. Les résultats pour les patients atteints de gliome ne se sont pas améliorés au cours des 30 dernières années”, a déclaré Maria G. Castro, Ph.D., R.C. Schneider Collegiate Professor of Neurosurgery au Michigan Medicine. Castro est l’auteur principal de l’étude, publiée aujourd’hui (26 mai 2022) dans la revue ACS Nano.
“Malgré les progrès réalisés en matière de survie dans de nombreux types de cancer, le gliome reste un problème tenace, avec seulement 5% des patients vivant cinq ans après leur diagnostic”, a déclaré l’auteur de l’étude, Pedro R. Lowenstein, M.D., Ph.D., Richard C. Schneider Collegiate Professor of Neurosurgery at Michigan Medicine.

Maria Castro, docteur en médecine, (à droite) avec le co-auteur Pedro Lowenstein, M.D., Ph.D. Crédit : Université du Michigan Rogel Cancer Center
Les gliomes sont souvent résistants aux thérapies traditionnelles, et l’environnement à l’intérieur de la tumeur supprime le système immunitaire, rendant inefficaces les nouvelles thérapies basées sur l’immunité. Si l’on ajoute à cela la difficulté de passer la barrière hémato-encéphalique, il devient encore plus difficile d’administrer des traitements efficaces à ces tumeurs.
Le laboratoire Castro-Lowenstein a vu une opportunité. La petite molécule inhibitrice AMD3100 a été mise au point pour bloquer l’action de CXCR12, une cytokine libérée par les cellules du gliome qui constitue un bouclier autour du système immunitaire, l’empêchant de se mobiliser contre la tumeur envahissante. Les chercheurs ont montré dans des modèles murins de gliome que l’AMD3100 empêchait le CXCR12 de se lier aux cellules myéloïdes immunosuppressives. En désarmant ces cellules, le système immunitaire reste intact et peut attaquer les cellules tumorales.
Mais l’AMD3100 avait du mal à atteindre la tumeur. Le médicament ne voyageait pas bien dans la circulation sanguine et ne passait pas la barrière hémato-encéphalique, un problème clé pour l’introduction de médicaments dans le cerveau.
Le laboratoire Castro-Lowenstein a collaboré avec Joerg Lahann, Ph.D., titulaire de la chaire Wolfgang Pauli d’ingénierie chimique à l’U-M College of Engineering, pour créer des nanoparticules à base de protéines afin d’encapsuler l’inhibiteur, dans l’espoir de l’aider à passer dans la circulation sanguine.
Castro s’est également mis en rapport avec Anuska V. Andjelkovic, M.D., Ph.D., professeur de pathologie et professeur chercheur en neurochirurgie au Michigan Medicine, dont les recherches portent sur la barrière hémato-encéphalique. Ils ont noté que les tumeurs du gliome créent des vaisseaux sanguins anormaux, interférant avec la circulation sanguine normale.
Les chercheurs ont injecté des nanoparticules chargées d’AMD3100 à des souris atteintes de gliomes. Les nanoparticules contenaient à leur surface un peptide qui se lie à une protéine présente principalement sur les cellules tumorales du cerveau. En se déplaçant dans la circulation sanguine vers la tumeur, les nanoparticules ont libéré l’AMD3100, qui a rétabli l’intégrité des vaisseaux sanguins. Les nanoparticules ont alors pu atteindre leur cible, où elles ont libéré le médicament, bloquant ainsi l’entrée des cellules myéloïdes immunosuppressives dans la masse tumorale. Cela a permis aux cellules immunitaires de tuer la tumeur et de retarder sa progression.
“Si vous n’avez pas de flux sanguin, rien ne pourra atteindre votre cible. C’est pourquoi les tumeurs sont si intelligentes. Mais l’AMD3100 restaure les conduits, ce qui permet aux nanoparticules d’atteindre la tumeur”, a déclaré Castro.
D’autres études sur des souris et des lignées cellulaires de patients ont démontré que le couplage de la nanoparticule AMD3100 avec la radiothérapie augmentait l’effet au-delà de la nanoparticule ou de la radiation seule.
Parmi les souris dont les tumeurs ont été éliminées, les chercheurs ont ensuite réintroduit la tumeur, simulant une récidive. Sanssans traitement supplémentaire, 60 % des souris sont restées sans cancer. Cela suggère que, comme un vaccin, AMD3100 a créé une mémoire immunitaire, permettant au système immunitaire de reconnaître et de détruire les cellules réintroduites. Bien qu’il ait empêché une récidive chez les souris, Castro a déclaré que cela était de bon augure pour au moins retarder la récidive chez les humains.
“Chaque gliome récidive. Il est très important pour la thérapie du gliome d’avoir cette mémoire immunologique”, a déclaré Castro.
Les premiers tests ont montré qu’il y avait peu ou pas d’impact sur les fonctions hépatiques, rénales ou cardiaques et que la numération sanguine des souris était normale après le traitement. La nanoparticule a une base similaire à celles qui ont été précédemment testées chez l’homme et qui se sont avérées sûres. Des tests de sécurité supplémentaires sont nécessaires avant de passer à un essai clinique.
Référence : ” Systemic delivery of an adjuvant CXCR4-CXCL-12 signaling inhibitor encapsulated in synthetic protein nanoparticles for glioma immunotherapy ” par Mahmoud S. Alghamri, Kaushik Banerjee, Anzar A. Mujeeb, Ava Mauser, Ayman Taher, Rohit Thalla, Brandon L. McClellan, Maria L. Varela, Svetlana M. Stamatovic, Gabriela Martinez-Revollar, Anuska V. Andjelkovic, Jason V. Gregory, Padma Kadiyala, Alexandra Calinescu, Jennifer A. Jiménez, April A. Apfelbaum, Elizabeth R. Lawlor, Stephen Carney, Andrea Comba, Syed Mohd Faisal, Marcus Barissi, Marta B. Edwards, Henry Appelman, Yilun Sun, Jingyao Gan, Rose Ackermann, Anna Schwendeman, Marianela Candolfi, Michael R. Olin, Joerg Lahann, Pedro R. Lowenstein et Maria G. Castro, 26 mai 2022, ACS Nano.
DOI : 10.1021/acsnano.1c07492
Autres auteurs : Mahmoud S. Alghamri, Kaushik Banerjee, Anzar A. Mujeeb, Ava Mauser, Ayman Taher, Rohit Thalla, Brandon L. McClellan, Maria L. Varela, Svetlana M. Stamatovic, Gabriela Martinez-Revollar, Jason V. Gregory, Padma Kadiyala, Alexandra Calinescu, Jennifer A. Jimenez, April A. Appelbaum, Elizabeth R. Lawlor, Stephen Carney, Andrea Comba, Syed Mohd Faisal, Marcus Barissi, Marta B. Edwards, Henry Appelman, Yilun Sun, Jingyao Gan, Rose Ackermann, Anna Schwendeman, Marianela Candolfi, Michael R. Olin.
Financement : Subventions des National Institutes of Health R37-NS094804, R01-NS105556, R01-NS122536, R01-NS124167, R21-NS123879-01, R37-NS094804, R01-NS105556, R01-NS122536, R01-NS124167, R21-NS123879-01, T32-CA009676, F31CA247104, F31CA247104 ; Rogel Cancer Center ; Michigan Medicine Department of Neurosurgery ; Pediatric Brain Tumor Foundation ; Leah’s Happy Hearts Foundation ; Ian’s Friends Foundation ; Chad Tough Foundation ; Smiles for Sophie Forever Foundation ; Agencia Nacional de Promocion Cientifica y Tecnologica, Argentina ; Instituto Nacional del Cancer Argentina, Asistencia Financiera IV.