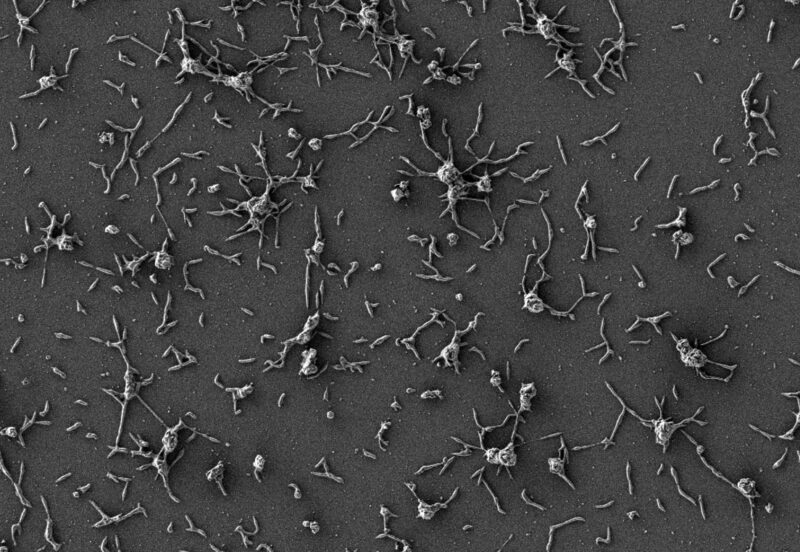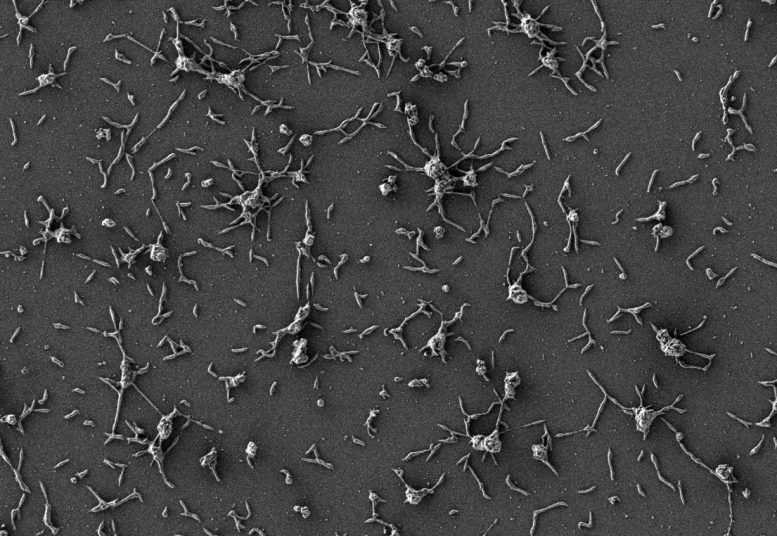
Image au microscope électronique à balayage de cellules de Mycoplasma pneumoniae, de petites bactéries naturellement adaptées au poumon humain. Crédit : Maria Lluch/CRG
Un traitement expérimental dissout les biofilms résistants aux antibiotiques chez la souris.
Des chercheurs du Center for Genomic Regulation (CRG) et de Pulmobiotics SL ont créé le premier « médicament vivant » pour traiter les bactéries résistantes aux antibiotiques qui se développent sur les surfaces des implants médicaux. Les chercheurs ont créé le traitement en supprimant la capacité d’une bactérie courante à provoquer une maladie et en la réutilisant pour attaquer les microbes nocifs à la place.
Le traitement expérimental a été testé sur des cathéters infectés in vitro, ex vivo, et in vivo, traitant avec succès les infections selon les trois méthodes de test. Selon les auteurs, l’injection de la thérapie sous la peau des souris a traité des infections chez 82 % des animaux traités.
Les résultats sont une première étape importante pour le développement de nouveaux traitements pour les infections affectant les implants médicaux tels que les cathéters, les stimulateurs cardiaques et les prothèses articulaires. Celles-ci sont très résistantes aux antibiotiques et représentent 80 % de toutes les infections contractées en milieu hospitalier.
L’étude est publiée aujourd’hui (6 octobre 2021) dans la revue Biologie des systèmes moléculaires. Ce travail a été soutenu par la Fondation « la Caixa » via l’appel CaixaResearch Health, le Conseil européen de la recherche (ERC), le projet MycoSynVac dans le cadre du programme européen de recherche et d’innovation Horizon 2020, la Generalitat de Catalunya et l’Instituto de Salud Carlos. III.

De gauche à droite : Margherita Scarpa, Claudio Santos, Luis Serrano, Carlos Piñero et Maria Lluch. Crédit : Centre de Régulation Génomique (CRG)
Le nouveau traitement cible spécifiquement les biofilms, des colonies de cellules bactériennes qui se collent sur une surface. Les surfaces des implants médicaux sont des conditions de croissance idéales pour les biofilms, où elles forment des structures impénétrables qui empêchent les antibiotiques ou le système immunitaire humain de détruire les bactéries qui s’y trouvent. Les bactéries associées au biofilm peuvent être mille fois plus résistantes aux antibiotiques que les bactéries flottantes.
Staphylococcus aureus est l’une des espèces les plus courantes de bactéries associées au biofilm. S. aureus les infections ne répondent pas aux antibiotiques conventionnels, obligeant les patients à retirer chirurgicalement tout implant médical infecté. Les thérapies alternatives comprennent l’utilisation d’anticorps ou d’enzymes, mais ce sont des traitements à large spectre qui sont hautement toxiques pour les tissus et les cellules normaux, provoquant des effets secondaires indésirables.
Les auteurs de l’étude ont émis l’hypothèse que l’introduction d’organismes vivants qui produisent directement des enzymes à proximité des biofilms est un moyen plus sûr et moins cher de traiter les infections. Les bactéries sont un vecteur idéal, car elles ont de petits génomes qui peuvent être modifiés à l’aide d’une simple manipulation génétique.
Les chercheurs ont choisi de concevoir Mycoplasma pneumoniae, une espèce courante de bactérie dépourvue de paroi cellulaire, ce qui facilite la libération des molécules thérapeutiques qui combattent l’infection tout en l’aidant à échapper à la détection du système immunitaire humain. Autres avantages de l’utilisation M. pneumoniae en tant que vecteur comprennent son faible risque de mutation de nouvelles capacités et son incapacité à transférer l’un de ses gènes modifiés à d’autres microbes vivant à proximité.
M. pneumoniae a d’abord été modifié afin qu’il ne cause pas de maladie. D’autres ajustements lui ont permis de produire deux enzymes différentes qui dissolvent les biofilms et attaquent les parois cellulaires des bactéries incrustées à l’intérieur. Les chercheurs ont également modifié la bactérie afin qu’elle sécrète des enzymes antimicrobiennes plus efficacement.
Les chercheurs visent d’abord à utiliser les bactéries modifiées pour traiter les biofilms qui se forment autour des tubes respiratoires, comme M. pneumoniae est naturellement adapté au poumon. « Notre technologie, basée sur la biologie synthétique et la biothérapie vivante, a été conçue pour répondre à toutes les normes de sécurité et d’efficacité pour une application dans les poumons, les maladies respiratoires étant l’une des premières cibles. Notre prochain défi consiste à aborder la production et la fabrication à grande échelle, et nous prévoyons de commencer les essais cliniques en 2023 », a déclaré María Lluch, co-auteure de l’étude et directrice scientifique de Pulmobiotics.
Les bactéries modifiées peuvent également avoir des applications à long terme pour d’autres maladies. « Les bactéries sont des véhicules idéaux pour la « médecine vivante », car elles peuvent transporter n’importe quelle protéine thérapeutique donnée pour traiter la source d’une maladie. L’un des grands avantages de la technologie est qu’une fois arrivés à destination, les vecteurs bactériens offrent une production continue et localisée de la molécule thérapeutique. Comme tout véhicule, nos bactéries peuvent être modifiées avec différentes charges utiles qui ciblent différentes maladies, avec potentiellement plus d’applications à l’avenir », explique le professeur de recherche ICREA Luis Serrano, directeur du CRG et co-auteur de l’étude.
Référence : « Engineering a genome-reduced bacterium to eliminer les biofilms de Staphylococcus aureus in vivo » 6 octobre 2021, Biologie des systèmes moléculaires.
DOI : 10.15252/msb.202010145