Les recherches menées au KAUST visent à améliorer la façon dont les cellules souches se déplacent dans le corps afin qu’elles puissent atteindre là où elles sont nécessaires après la transplantation. Crédit : © 2021 KAUST ; Anastasia Serin
Les molécules se déplacent dans des protubérances allongées pour aider à stabiliser les cellules migrantes à l’intérieur de la circulation sanguine.
Une conception expérimentale innovante montre, en temps réel et à l’échelle d’une seule molécule, comment les cellules souches ralentissent leur roulement à l’intérieur du système circulatoire en faisant croître de longues attaches qui se fixent à la surface interne des vaisseaux sanguins. La stratégie pourrait aider les chercheurs à améliorer les greffes de cellules souches et à trouver de nouveaux traitements pour les cancers métastasants.
De nombreuses cellules du corps humain voyagent à travers les vaisseaux sanguins d’un organe à un autre pour remplir des fonctions spécifiques. Par exemple, les cellules immunitaires migrent vers les tissus enflammés et les cellules cancéreuses se propagent vers de nouveaux organes. Les cellules souches voyagent également vers de nouveaux endroits pour se développer en différents tissus. « Ce « homing » de cellules souches, où les cellules migrent vers leur nouveau lieu de résidence, est également essentiel pour une greffe de moelle osseuse réussie pour le traitement de diverses maladies », explique Satoshi Habuchi, qui a dirigé l’étude.
Le homing est un processus en plusieurs étapes dans lequel les cellules roulent lentement sur la paroi interne des vaisseaux sanguins, puis adhèrent à la paroi une fois qu’elles atteignent le site auquel elles sont destinées, et enfin transmigrent à travers la paroi vasculaire dans le tissu.
Les scientifiques savaient déjà que les cellules autodirectrices produisent des attaches contenant des ligands capables de détecter et de se lier aux molécules d’adhésion sur la paroi des vaisseaux sanguins. Jusqu’à présent, cependant, les scientifiques n’avaient pas pu visualiser directement ce roulement pour comprendre exactement ce qui se passe au niveau moléculaire.

Le « homing » des cellules souches est un processus par lequel les cellules souches migrent à travers le système circulatoire pour arriver à l’endroit où elles sont nécessaires dans le corps humain. Crédit : © 2021 KAUST ; Anastasia Serin
Satoshi, Merzaban et leurs équipes ont pu imiter le roulement de cellules en utilisant un système microfluidique. “L’étape d’attache et de roulement du homing avait déjà été décrite comme une simple liaison entre les sélectines sur l’endothélium et leurs ligands sur les cellules souches”, explique Ph.D. étudiant Bader Al Alwan. “Nos résultats ont démontré que l’étape initiale du homing est beaucoup plus dynamique et compliquée.”

Une partie de la recherche de l’équipe est axée sur la compréhension des raisons pour lesquelles les cellules cancéreuses cancéreuses surpassent les cellules normales dans leur capacité à migrer dans le corps humain. Crédit : © 2021 KAUST ; Anastasia Serin
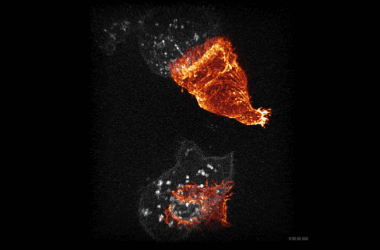
L’équipe a découvert que les microvillosités individuelles à la surface des cellules autodirectrices s’allongent pour former des attaches individuelles. Les ligands des microvillosités s’étendent rapidement à travers les attaches afin qu’ils puissent « flairer » la sélectine dans la paroi des vaisseaux sanguins. Une fois localisés, les ligands se lient aux sélectines, attachant l’attache à la paroi du vaisseau. Cela aide la cellule à résister à toute la force du flux sanguin. Lorsque le flux sanguin exerce une pression sur le dessus de la cellule, il roule vers l’avant, étirant l’attache jusqu’à ce qu’elle atteigne un point critique lorsqu’elle se brise et se retourne pour venir devant la cellule. Maintenant appelé fronde, il est utilisé pour ralentir la cellule afin qu’elle puisse rechercher les molécules qui signalent où se trouve sa nouvelle maison.
« Quand nous avons commencé, nous ne nous attendions pas à ce que la morphologie cellulaire joue un rôle aussi critique dans la stabilisation du roulement cellulaire », explique Al Alwan. “Nous avons également été surpris par la mesure dans laquelle la morphologie change, certaines attaches se fusionnant en plusieurs et d’autres s’étendant sur plus de dix fois la longueur de la cellule.”

L’équipe, dirigée par Satoshi (à droite), souhaite créer une carte plus précise des protéines présentes à chaque étape du processus de ralliement et de migration. Crédit : © 2021 KAUST ; Anastasia Serin
« Nos recherches sont axées sur la compréhension de la façon dont diverses cellules se déplacent dans le corps à l’aide de systèmes d’adhésion. Par exemple, l’un des objectifs est d’améliorer le mouvement des cellules souches dans le corps afin qu’elles puissent se rendre là où elles sont nécessaires après une transplantation ou dans d’autres contextes pathologiques. Nous nous efforçons également de comprendre comment et pourquoi les cellules cancéreuses surpassent les cellules normales dans leur capacité à migrer afin que nous puissions développer des méthodes pour inhiber leurs métastases. En utilisant les tests sophistiqués développés par Satoshi et son équipe, nous souhaitons également créer une carte plus précise des protéines présentes à chaque étape du processus de ralliement et de migration pour identifier quand et où elles sont importantes pendant la migration », explique le bioscientifique Jasmeen. Merzaban, le co-investigateur principal de l’étude.
Référence : « L’imagerie à molécule unique et la plate-forme microfluidique révèlent les mécanismes moléculaires du roulement des cellules leucémiques » par Bader Al Alwan, Karmen AbuZineh, Shuho Nozue, Aigerim Rakhmatulina, Mansour Aldehaiman, Asma S. Al-Amoodi, Maged F. Serag, Fajr A. Aleisa, Jasmeen S. Merzaban et Satoshi Habuchi, 14 juillet 2021, Biologie des communications.
DOI : 10.1038 / s42003-021-02398-2