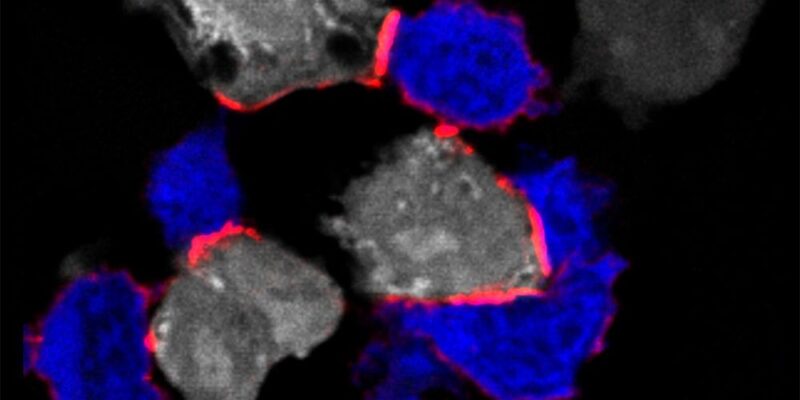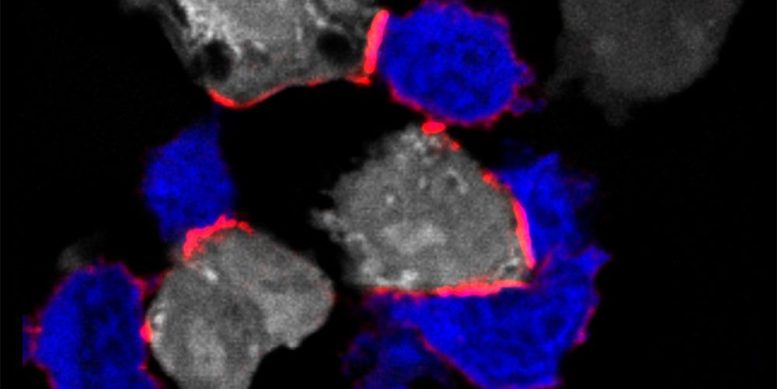
Image immunofluorescente montrant des cellules T (en bleu) attaquant des cellules tumorales (en blanc) en formant une synapse immunitaire avec le LFA-1 (conformation de la tête ouverte – marquée en rouge). Une nouvelle étude a identifié le magnésium extracellulaire comme un modulateur immunitaire critique des cellules T CD8+. Crédit : J. Loetscher et al., Cell (2022)
Le niveau de magnésium dans le sang est un facteur important dans la capacité du système immunitaire à s’attaquer aux agents pathogènes et aux cellules cancéreuses. Dans le journal Celluledes chercheurs de l’Université de Bâle et de l’Hôpital universitaire de Bâle ont indiqué que les cellules T ont besoin d’une quantité suffisante de magnésium pour fonctionner efficacement. Leurs conclusions pourraient avoir des implications importantes pour les patients atteints de cancer.
La carence en magnésium est associée à une variété de maladies, telles que les infections et le cancer. Des études antérieures ont montré que les tumeurs cancéreuses se propageaient plus rapidement dans l’organisme des souris soumises à un régime pauvre en magnésium et que leur défense contre les virus de la grippe était également compromise. Cependant, peu de recherches ont été menées jusqu’à présent sur la façon dont ce minéral affecte exactement le système immunitaire.
Aujourd’hui, des chercheurs dirigés par le professeur Christoph Hess, du département de biomédecine de l’université de Bâle et de l’hôpital universitaire de Bâle et du département de médecine de l’université de Cambridge, ont découvert que les cellules T ne peuvent éliminer efficacement les cellules anormales ou infectées que dans un environnement riche en magnésium. Plus précisément, le magnésium est important pour la fonction d’une protéine de surface des cellules T appelée LFA-1.
LFA-1 agit comme un site d’amarrage, qui joue un rôle clé dans l’activation des cellules T. “Toutefois, à l’état inactif, ce site d’accueil est dans une conformation courbée et ne peut donc pas se lier efficacement aux cellules infectées ou anormales”, explique Christoph Hess. “C’est là que le magnésium entre en jeu. Si le magnésium est présent en quantité suffisante à proximité des lymphocytes T, il se lie au LFA-1 et veille à ce qu’il reste dans une position étendue – et donc active.”
Des résultats potentiellement importants pour les patients atteints de cancer
Le fait que le magnésium soit essentiel au fonctionnement des lymphocytes T peut constituer une découverte très importante pour les immunothérapies modernes contre le cancer. Ces thérapies visent à mobiliser le système immunitaire – en particulier les cellules T cytotoxiques – pour combattre les cellules cancéreuses. Dans des modèles expérimentaux, les chercheurs ont pu montrer que la réponse immunitaire des cellules T contre les cellules cancéreuses était renforcée par une augmentation de la concentration locale de magnésium dans les tumeurs.
“Afin de vérifier cette observation sur le plan clinique, nous cherchons maintenant des moyens d’augmenter la concentration de magnésium dans les tumeurs de manière ciblée”, indique Christoph Hess. Le caractère prometteur de ces stratégies est démontré par d’autres analyses effectuées par l’équipe de recherche travaillant avec Christoph Hess et son postdoc, le Dr Jonas Lötscher, auteur principal de l’étude. En utilisant des données provenant d’études déjà réalisées sur des patients atteints de cancer, les chercheurs ont pu montrer que les immunothérapies étaient moins efficaces chez les patients dont le taux de magnésium dans le sang était insuffisant.
Les données existantes ne permettent pas de répondre à la question de savoir si un apport régulier de magnésium a un impact sur le risque de développer un cancer, déclare Lötscher. “Dans une prochaine étape, nous prévoyons des études prospectives pour tester l’effet clinique du magnésium en tant que catalyseur du système immunitaire.”
Référence : “Magnesium sensing via LFA-1 regulates CD8+ T cell effector function” par Jonas Lötscher, Adrià-Arnau Martí i Líndez, Nicole Kirchhammer, Elisabetta Cribioli, Greta Giordano, Marcel P. Trefny, Markus Lenz, Sacha I.. Rothschild, Paolo Strati, Marco Künzli, Claudia Lotter, Susanne H. Schenk, Philippe Dehio, Jordan Löliger, Ludivine Litzler, David Schreiner, Victoria Koch, Nicolas Page, Dahye Lee, Jasmin Grählert, Dmitry Kuzmin, Anne-Valérie Burgener, Doron Merkler, Miklos Pless, Maria L. Balmer, Walter Reith et Jörg Huwyler, 19 janvier 2022, Cellule.
DOI: 10.1016/j.cell.2021.12.039