Un groupe de recherche international dirigé par le professeur Toru Takumi (chercheur invité principal, Centre RIKEN de recherche sur la dynamique des biosystèmes) et le chercheur Chia-wen Lin de l’école supérieure de médecine de l’université de Kobe a montré que l’autisme idiopathique…[1] est causé par l’épigénétique[2] épigénétiques[2] dans les cellules hématopoïétiques pendant le développement du fœtus, ce qui entraîne un dérèglement immunitaire dans le cerveau et l’intestin. Les résultats de l’étude ont révélé que dans l’autisme, il y a des anomalies immunitaires qui peuvent être vues dans le cerveau et l’intestin.
On espère qu’une classification plus poussée de la physiopathologie de l’autisme conduira à la création de nouvelles stratégies de traitement de l’autisme et d’autres troubles du développement neurologique.[3]
Les résultats de cette recherche seront publiés dans le journal Molecular Psychiatry le lundi 2 mai 2022.
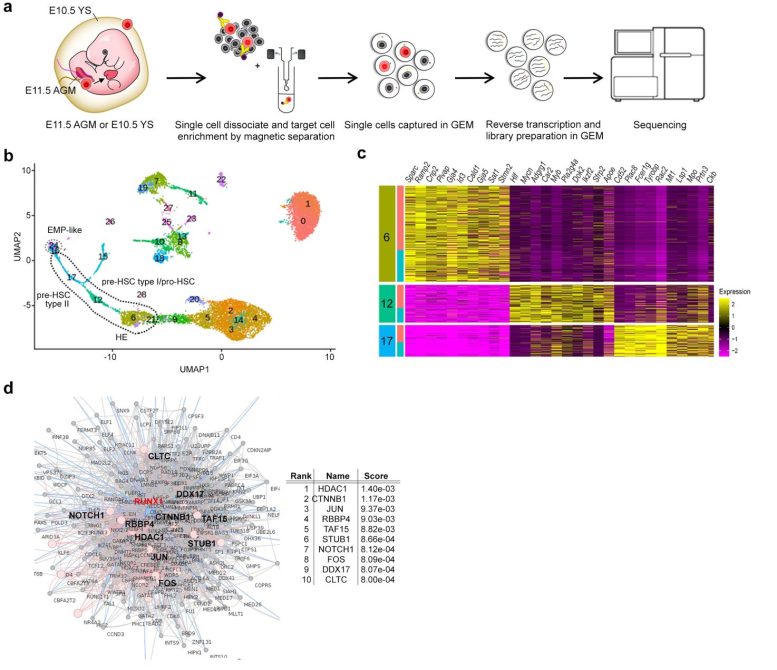
Figure 1. a : Schéma expérimental. Les cellules sont isolées du sac vitellin fœtal et de l’AGM et leurs transcriptions sont séquencées par séquençage de nouvelle génération. b : Les groupes de cellules provenant de l’analyse unicellulaire des cellules progénitrices de l’AGM sont représentés. c : Carte thermique des 10 gènes les plus enrichis dans les trois groupes de cellules (6, 12, 17) de b. d : Analyse d’enrichissement des gènes basée sur l’interréseau de protéines de RUNX1, un facteur de transcription essentiel à la transition endothéliale-hématopoïétique (TEH), au cours de laquelle les cellules endothéliales vasculaires donnent naissance aux cellules souches hématopoïétiques. Crédit : Figure issue de l’article publié dans Molecular Psychiatry (2022) (DOI:10.1038/s41380-022-01566-y).
Points principaux
- Chez les souris BTBR[4]un modèle animal d’autisme, nous avons identifié HDAC1[5] comme l’étiologie des anomalies immunitaires par le biais d’une analyse unicellulaire. ARN-seq[6] analyse de l’AGM[7] cellules sanguines.
- Analyse ARN-seq unicellulaire du sac vitellin.[8] cellules hématopoïétiques a également identifié HDAC1 comme étant à l’origine de la microglie[9] anomalies du développement.
- La régulation de l’activité HDAC pendant le stade fœtal a amélioré l’inflammation dans le cerveau et la dysrégulation immunitaire chez les souris BTBR.
- Nous avons constaté que les changements dans l’environnement intestinal, en particulier dans le système immunitaire, conduisent à des anomalies dans le microbiote intestinal.[10] des souris BTBR.
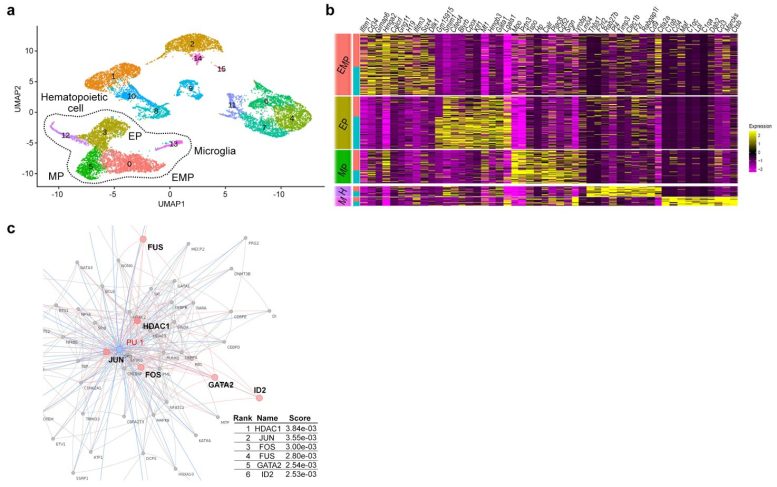
Figure 2. a : Groupes de cellules provenant de l’analyse unicellulaire des sacs vitellins. b : Carte thermique des 10 gènes les plus enrichis dans les cinq groupes de cellules en a. c : Interaction protéine-protéine de PU.1, un facteur de transcription important pour le développement microglial. Analyse d’enrichissement des gènes basée sur le réseau. Crédit : Figure dérivée de l’article publié dans Molecular Psychiatry (2022) (DOI:10.1038/s41380-022-01566-y).
Contexte de la recherche
L’autisme (trouble du spectre autistique) est un trouble neurologique du développement qui reste largement inexploré malgré l’augmentation rapide du nombre de patients. Les anomalies immunitaires, désormais considérées comme la cause de nombreuses maladies, jouent également un rôle important dans le développement de l’autisme. Une inflammation cérébrale et des perturbations du système immunitaire périphérique sont fréquemment observées chez les patients autistes. En outre, les anomalies immunitaires s’accompagnent d’anomalies du microbiote intestinal, qui serait également impliqué dans la pathogenèse de la maladie via l’axe cerveau-intestin.[11]. Cependant, les mécanismes essentiels à l’origine de ces anomalies immunitaires n’ont pas encore été élucidés.
Étant donné les étapes critiques du développement des insultes immunitaires et l’implication importante du système immunitaire dans le développement de l’autisme, l’équipe de recherche a émis l’hypothèse qu’une étiologie commune sous-tend la dysrégulation immunitaire généralisée et trouve son origine dans différents types de cellules progénitrices. L’analyse s’est concentrée sur les cellules hématopoïétiques dont dérivent les cellules immunitaires, ainsi que sur le sac vitellin (YS) et l’aorte-gonade-mésonéphros (AGM), qui sont impliqués dans l’hématopoïèse au stade fœtal. Ces résultats recherchent un ancêtre commun de l’inflammation dans le cerveau et des anomalies du système immunitaire périphérique. Dans cette étude, les souris BTBR ont été utilisées comme modèle idiopathique de l’autisme.
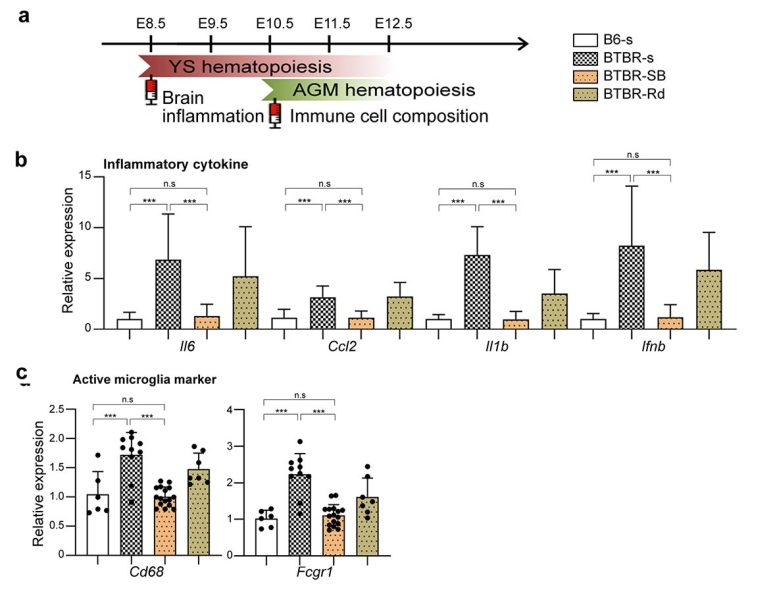
Figure 3. a : Les inhibiteurs, le butyrate de sodium (SB) ou la romidepsine (Rd) administrés à 8,5 et 10,5 jours embryonnaires, soit le début de l’hématopoïèse primaire dans le sac vitellin et l’AGM, respectivement, ont été comparés au groupe témoin salin (s). b : Dans le cerveau des souris BTBR, les cytokines inflammatoires (Il6, Ccl2, Il1b, Ifnb) ont été supprimées. c : Les marqueurs de la microglie activée (Cd68, Fcgr1) ont été supprimés. Crédit : Figure dérivée de l’articlepublié dans Molecular Psychiatry (2022) (DOI:10.1038/s41380-022-01566-y)
Résultats de la recherche
Le séquençage de l’ARN unicellulaire (sc-RNA seq) des souris BTBR a permis de retracer l’origine des anomalies immunitaires aux stades embryonnaires du sac vitellin (YS) et de l’aorte-gonade-mésonéphros (AGM) et d’identifier où se différencient les macrophages (microglie) et les cellules immunitaires périphériques. Hématopoïèse définitive[12] L’analyse au niveau de la cellule unique dans l’YS et l’AGM a permis d’identifier des mécanismes pathologiques au niveau moléculaire au sein de rares cellules progénitrices dans les premiers stades du développement. Nous avons notamment découvert un mécanisme commun de régulation transcriptionnelle par le biais de HDAC1, une histone désacétylase, qui sous-tend ces pathologies (Figures 1 et 2).
Nous avons également montré que la manipulation des mécanismes épigénétiques au cours de stades spécifiques du développement peut restaurer les anomalies immunitaires dans le cerveau et les tissus périphériques. Plus précisément, nous avons identifié l’histone désacétylase HDAC1 comme un mécanisme commun. L’administration d’inhibiteurs de cette histone (butyrate de sodium ou Romidepsin) pendant le stade fœtal chez les souris BTBR a supprimé les cytokines inflammatoires élevées.[13] et l’activation microgliale (Figure 3).
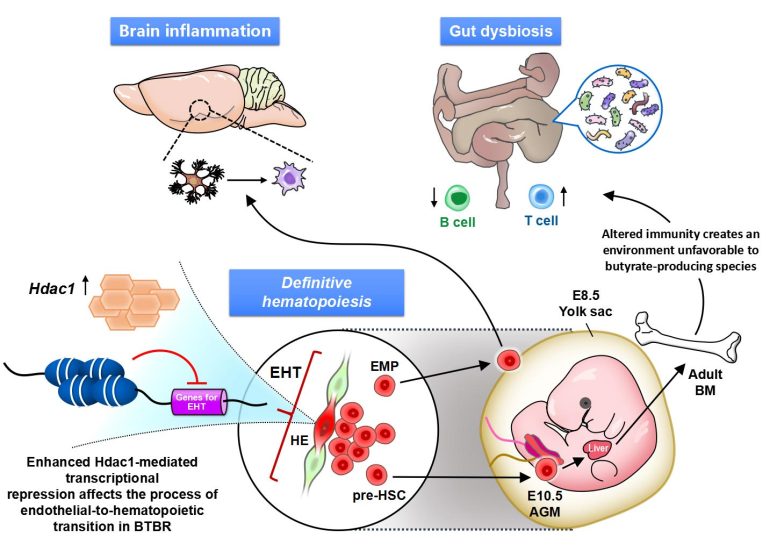
Figure 4. La répression transcriptionnelle par la promotion de l’histone désacétylase 1 (HDAC1) affecte le processus allant des cellules endothéliales vasculaires à la production de cellules souches hématopoïétiques (EHT). Les cellules progénitrices érythroïdes/myéloïdes (EMP) dans le sac vitellin (Yolk sac) activent la microglie et affectent l’inflammation dans le cerveau ; les pré-CSH dans l’AGM se différencient dans la moelle osseuse (BM) ; et le système immunitaire altéré affecte le microbiote intestinal. Crédit : Figure dérivée de l’article publié dans Molecular Psychiatry (2022) (DOI:10.1038/s41380-022-01566-y).
Nous avons en outre démontré que l’immunité dysrégulée peut déterminer une dysbiose intestinale de profils spécifiques chez les souris modèles autistes, ce qui fait des biomarqueurs potentiels des Treg et de la dysbiose intestinale un moyen de catégoriser le sous-type de TSA à immunité déréglée.
D’après ce qui précède, il est clair que les anomalies du cerveau et des organes périphériques (comme les intestins) observées dans l’autisme sont causées par des anomalies épigénétiques dans la lignée des cellules souches hématopoïétiques, l’ancêtre des cellules immunitaires (figure 4).
Perspectives
Nos résultats fournissent non seulement la pièce manquante pour résoudre le puzzle de longue date de la dysrégulation immunitaire systémique dans l’autisme, mais font également allusion au rôle de la perturbation épigénétique comme étiologie commune parmi différents modèles d’autisme de facteurs de risque environnementaux. En outre, pour développer une médecine de précision pour les TSA à l’avenir, le sous-typage des TSA en fonction du mécanisme de pathogenèse est une première étape clé pour résoudre l’hétérogénéité des TSA et ouvrir une nouvelle voie pour le traitement des TSA.
Glossaire
- Autisme idiopathique : L’autisme est considéré comme un trouble multifactoriel qui peut être causé par des facteurs génétiques et environnementaux. Il est entendu que des facteurs génétiques tels que des anomalies génétiques et génomiques peuvent causer l’autisme, mais il existe encore de nombreux cas d’autisme dont la cause est inconnue. L’autisme dont la cause ne peut être précisée (y compris les facteurs environnementaux) est appelé autisme idiopathique.
- Épigénétique : L’étude des schémas d’hérédité qui affectent le fonctionnement des gènes mais qui n’impliquent pas d’altérations de l’ADN. ADN séquence d’ADN. Même si l’information contenue dans le génome reste la même, des mécanismes biologiques tels que la méthylation de l’ADN et la modification chimique des protéines histones peuvent modifier l’expression génétique.
- Trouble du développement neurologique : Anciennement appelé troubles du développement, il s’agit d’un trouble qui survient en relation avec un problème fonctionnel du cerveau.
- Souris BTBR : Un type de souris congéniques. A partir de l’analyse du comportement systémique de cette lignée de souris, il a été rapporté que le comportement de la souris BTBR est le plus proche du comportement autistique. C’est pourquoi elle est connue comme le modèle de souris pour l’autisme idiopathique.
- HDAC1 :L’histone désacétylase 1 régule l’expression des gènes en modifiant les protéines histones.
- RNA-seq unicellulaire : Méthode permettant d’étudier de manière exhaustive les aspects qualitatifs et quantitatifs de tous les ARNm présents dans les cellules individuelles à l’aide d’un séquenceur de nouvelle génération. En combinant cette méthode avec des méthodes d’analyse statistique telles que la réduction de la dimension, il est possible de classer les cellules en fonction de leur expression génétique et d’estimer l’état de la cellule. En outre, la réalisation d’une analyse d’ordonnancement pseudo-temporel basée sur les changements du profil d’expression génétique permet de décrire les fibres de l’état cellulaire qui accompagnent le développement.
- AGM : La région de l’aorte, de la gonade et du mésonéphros (AGM) est une région de l’organisme.Site hématopoïétique à l’intérieur du fœtus (c’est-à-dire où se forment les composants cellulaires du sang du fœtus).
- Sac vitellin : Pendant la grossesse, le sac, qui est une membrane entourant le jaune d’œuf, est également un site hématopoïétique (hématopoïèse primaire).
- Microglie : Type de cellule gliale du système nerveux central responsable du système immunitaire central. Les microglies sont également appelées les macrophages résidents du système nerveux central. Contrairement à d’autres cellules gliales (comme les astrocytes et les oligodendrocytes), la microglie est issue de cellules précurseurs dérivées du sac vitellin.
- Microbiote intestinal : groupe de bactéries présentes dans l’intestin, également appelé flore intestinale. Les progrès récents de la recherche utilisant un séquenceur de nouvelle génération pour analyser le métagénome des bactéries intestinales ont montré des liens avec divers troubles, dont l’autisme.
- Axe cerveau-intestin : La relation entre le cerveau et l’intestin, également appelée connexion cerveau-intestin. Une communication bidirectionnelle se produit entre le cerveau et l’intestin par le biais de moyens tels que le système nerveux autonome et les facteurs humoraux (par exemple, les hormones et les cytokines). Récemment, ce système de communication bidirectionnelle entre le microbiome intestinal (microbiote) et le cerveau a fait l’objet d’une grande attention.
- Hématopoïèse définitive : Pendant la période fœtale, l’hématopoïèse commence dans le sac vitellin par une hématopoïèse primaire, puis une hématopoïèse secondaire se produit dans la région AGM. L’hématopoïèse ultérieure pendant la période fœtale se produit dans le foie et enfin dans la moelle osseuse. L’hématopoïèse se poursuit tout au long de la vie d’une personne, la moelle osseuse étant le site principal de ce processus.
- Cytokine inflammatoire : Molécule de signalisation sécrétée par les cellules immunitaires, elle provoque une inflammation.
Référence : “Un mécanisme épigénétique commun à différentes origines cellulaires sous-tend la dysrégulation immunitaire systémique dans un modèle de souris autiste idiopathique” par Chia-Wen Lin, Dian E. Septyaningtrias, Hsu-Wen Chao, Mikiko Konda, Koji Atarashi, Kozue Takeshita, Kota Tamada, Jun Nomura, Yohei Sasagawa, Kaori Tanaka, Itoshi Nikaido, Kenya Honda, Thomas J. McHugh et Toru Takumi, 2 mai 2022, Psychiatrie moléculaire.
DOI: 10.1038/s41380-022-01566-y
Remerciements
Cette recherche a été financée par des sources dont celles énumérées ci-dessous :
- Les subventions suivantes de la Société japonaise pour la promotion de la science (JSPS) : Subvention d’aide à la recherche scientifique (S).
- Programme de recherche stratégique pour les sciences du cerveau de l’Agence japonaise pour la recherche et le développement médical.
- Subvention de recherche de la Fondation scientifique Takeda.