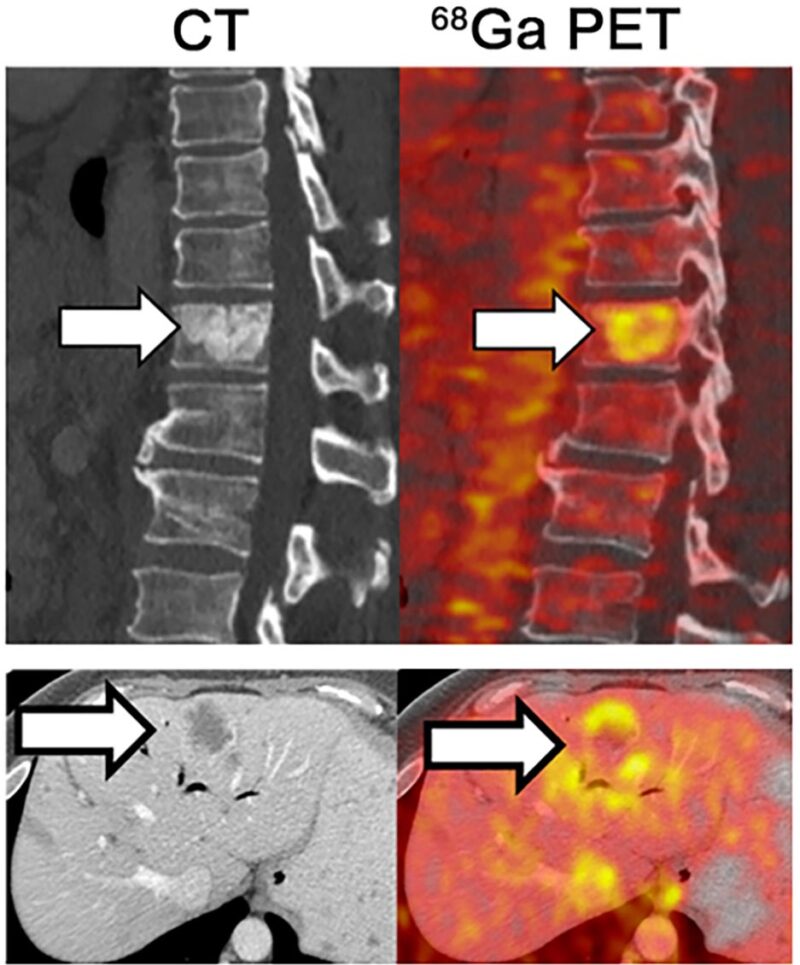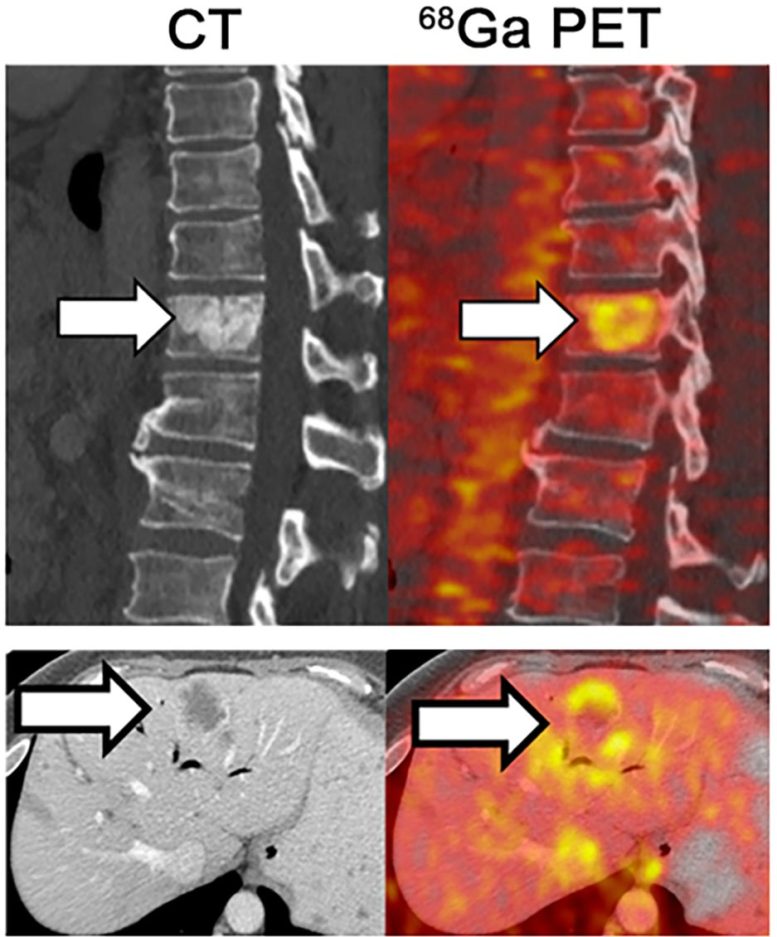
L’imagerie TEP (à droite) montre l’accumulation de fer dans les tumeurs métastatiques se développant dans la colonne vertébrale et le foie de patients atteints d’adénocarcinome du canal pancréatique. Crédit : 2022 Jiang et al. Publié à l’origine dans le Journal of Experimental Medicine. https://doi.org/10.1084/jem.20210739
Des chercheurs de l’Université de Californie, San Francisco (UCSF), ont découvert que les cellules porteuses de la mutation la plus courante dans le cancer humain accumulent de grandes quantités de fer ferreux et que cette “ferroaddiction” peut être exploitée pour délivrer spécifiquement de puissants médicaments anticancéreux sans nuire aux cellules normales et saines. La stratégie thérapeutique, décrite dans une étude qui a été publiée le 9 mars 2022 dans la revue Journal of Experimental Medicine (JEM), pourrait être utilisé pour traiter une grande variété de cancers provoqués par des mutations dans le système immunitaire. KRAS gène.
Mutations dans KRAS sont présentes dans de nombreux cancers et sont particulièrement fréquentes dans l’adénocarcinome du canal pancréatique (PDA), le cancer colorectal, la leucémie myéloïde aiguë et l’adénocarcinome pulmonaire. Au total, KRAS On pense que les mutations KRAS sont à l’origine d’un quart des décès par cancer en activant des voies de signalisation cellulaire qui favorisent la prolifération et la survie des cellules. Ces voies de signalisation peuvent être bloquées par des médicaments qui inhibent certaines des protéines activées par KRAS, mais, en plus de tuer les cellules cancéreuses, ces médicaments sont hautement toxiques pour les cellules et les tissus sains, ce qui limite leur utilisation aux doses nécessaires pour inhiber la signalisation dans les cellules cancéreuses.
“Par exemple, les inhibiteurs des enzymes MEK1/2 ont montré un bénéfice clinique, mais l’approche souffre de toxicités limitant les doses dans l’œil, la peau, l’intestin et d’autres organes”, explique Eric A. Collisson, MD, professeur au département de médecine de l’UCSF. “L’expérience clinique a montré que le dosage durable de ces inhibiteurs est souvent bien inférieur à la dose approuvée par la FDA, ce qui entrave gravement l’intensité de la dose pouvant être atteinte dans la cellule tumorale et limite finalement l’efficacité clinique.”
Dans le nouveau JEM étude, le premier auteur Honglin Jiang et ses collègues développent une méthode pour cibler les inhibiteurs de MEK, et potentiellement d’autres agents anticancéreux, pour . KRAS-sans nuire aux autres tissus sains de l’organisme.
Les chercheurs ont découvert qu’une grande variété de KRAS-Les chercheurs ont découvert qu’une grande variété de tumeurs dirigées par KRAS présentent une activité accrue des gènes impliqués dans l’absorption et le métabolisme du fer et, dans le cas du PDA, cette augmentation de l’activité des gènes est corrélée à des durées de survie plus courtes. Les examens TEP des patients atteints de PDA ont montré que leurs tumeurs accumulaient des niveaux élevés de fer. Jiang et ses collègues se sont demandés si cette dépendance au fer pouvait permettre de cibler plus précisément ces cellules cancéreuses.
“Nous avons découvert que les niveaux élevés de fer, en particulier dans sa forme ferreuse, Fe2+ ferreux, Fe2+sont provoqués par des maladies oncogènes. KRASNous avons donc émis l’hypothèse que les mutants KRAS-Nous avons donc émis l’hypothèse que les cellules tumorales PDA mutantes KRAS pourraient être ciblées sélectivement par un conjugué médicamenteux activable par le fer ferreux (FeADC)”, explique Adam R. Renslo, professeur au département de chimie pharmaceutique de l’UCSF, qui a dirigé l’étude.
Les FeADC sont des versions inactives de médicaments qui se décomposent en présence de Fe2+ libérant ainsi la version active du médicament. Cette approche a été inspirée par des médicaments antipaludiques comme l’artémisinine qui ciblent le Fe2+dans le parasite lorsqu’il envahit les globules rouges et dégrade l’hémoglobine, produisant de grandes quantités de fer héminique libre.
Renslo et son équipe ont synthétisé une version FeADC du cobimetinib, un inhibiteur de MEK approuvé par la FDA. Les tests de laboratoire ont montré que ce conjugué médicamenteux, nommé TRX-cobimetinib, avait peu d’effet sur les cellules de la peau ou de la rétine humaine mais était activé à l’intérieur. KRASmutant, inhibant la voie de signalisation KRAS-MEK et bloquant la croissance cellulaire.
Les chercheurs ont ensuite testé le TRX-cobimetinib dans plusieurs modèles de souris différents de .KRAS-y compris la PDA et l’adénocarcinome pulmonaire. Dans chaque cas, le TRX-cobimetinib a inhibé la croissance tumorale tout aussi bien que le cobimetinib normal. Cependant, contrairement au cobimétinib normal, le TRX-cobimétinib n’a causé aucun dommage détectable aux autres tissus sains. Cette absence de toxicité a permis aux chercheurs de combiner le traitement par TRX-cobimetinib avec d’autres médicaments anticancéreux. Ces thérapies combinées se sont avérées encore plus efficaces pour inhiber la croissance des tumeurs avec peu d’effets secondaires sur les autres tissus.
“Dans cette étude,nous décrivons une stratégie thérapeutique qui permet de mettre en place des thérapies combinées plus tolérables et plus efficaces ciblant les voies de signalisation enKRAS-La découverte de la ferrobactériologie exploitable pharmacologiquement permet d’améliorer la tolérance et l’efficacité des thérapies combinées ciblant les voies de signalisation dans les tumeurs induites par le gène KRAS“, explique M. Collisson. “La découverte de la ferroaddiction exploitable pharmacologiquement dansKRAS-La découverte d’une ferroaddiction pharmacologiquement exploitable dans les cancers induits par le gène KRASest prometteuse pour améliorer le traitement des cancers mortels grâce à une approche praticable et généralisable de la conception, du développement et des tests cliniques des FeADC.”
Pour plus d’informations sur cette recherche, voir Traiter les tumeurs difficiles en exploitant la “dépendance” des cellules cancéreuses au fer.
Référence : “Ferrous iron-activatable drug conjugate achieves potent MAPK blockade in KRAS-driven tumors” par Honglin Jiang, Ryan K. Muir, Ryan L. Gonciarz, Adam B. Olshen, Iwei Yeh, Byron C. Hann, Ning Zhao, Yung-hua Wang, Spencer C. Behr, James E. Korkola, Michael J. Evans, Eric A. Collisson et Adam R. Renslo, 9 mars 2022,Journal of Experimental Medicine.
DOI : 10.1084/jem.20210739
Financement : NIH/National Cancer Institute, Programme de recherche médicale dirigé par le Congrès, familles Shorenstein, Rhombauer et Preston.