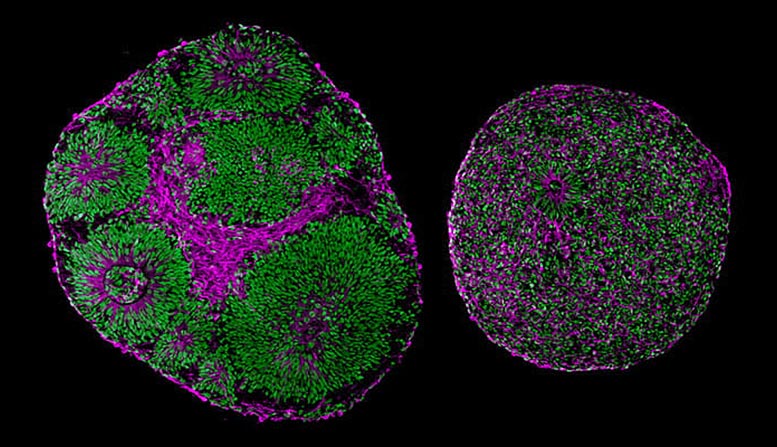
Des images microscopiques révèlent des différences significatives de taille et de structure entre les organoïdes cérébraux dérivés d’un patient atteint du syndrome de Pitt-Hopkins (à droite) et d’un témoin (à gauche). Crédit : UC San Diego Health Sciences
Une étude de l’Université de Californie à San Diego (UCSD) utilise des tissus cérébraux humains cultivés en laboratoire pour identifier les anomalies neuronales du syndrome de Pitt-Hopkins et tester les outils de thérapie génique.
Dans une étude publiée le 02 mai 2022 dans la revue Nature Communications, des scientifiques de l’école de médecine de l’Université de Californie à San Diego ont utilisé des organoïdes de cerveau humain pour découvrir comment une mutation génétique associée à une forme sévère d’autisme perturbe le développement neuronal. L’utilisation d’outils de thérapie génique pour rétablir la fonction du gène a permis de restaurer la structure et la fonction neuronales.
Plusieurs maladies neurologiques et neuropsychiatriques, dont les troubles du spectre autistique (TSA) et la schizophrénie, ont été liées à des mutations du facteur de transcription 4 (TCF4), un gène essentiel au développement du cerveau. Les facteurs de transcription régulent l’activation ou la désactivation d’autres gènes, de sorte que leur présence, ou leur absence, peut avoir un effet domino dans l’embryon en développement. On sait encore peu de choses sur ce qui se passe dans le cerveau humain lorsque les facteurs de transcription sont activés. TCF4 est muté.
Pour explorer cette question, les chercheurs se sont concentrés sur le syndrome de Pitt-Hopkins, un TSA spécifiquement causé par des mutations dans le gène TCF4 . TCF4. Les enfants atteints de cette maladie génétique présentent de profonds handicaps cognitifs et moteurs et sont généralement non verbaux.
Syndrome de Pitt-Hopkins (PTHS) est une maladie génétique rare caractérisée par un retard de développement, de l’épilepsie, des traits faciaux distinctifs et une possible hyperventilation intermittente suivie d’apnée. Au fur et à mesure des découvertes sur le syndrome de Pitt-Hopkins, le spectre de développement de la maladie s’élargit pour englober les difficultés liées à l’autisme, l’anxiété, le TDAH et les troubles sensoriels. Il est lié à une anomalie du chromosome 18, en particulier à une expression inadéquate du gène TCF4.
Les modèles murins existants du syndrome de Pitt-Hopkins ne parviennent pas à reproduire avec précision les caractéristiques neuronales des patients. L’équipe de l’UCSD a donc créé un modèle de recherche humain de cette maladie. En utilisant la technologie des cellules souches, ils ont converti les cellules de la peau des patients en cellules souches, qui ont ensuite été développées en organoïdes cérébraux tridimensionnels, ou “mini-cerveaux”.
Les premières observations des organoïdes cérébraux ont révélé un grand nombre de différences structurelles et fonctionnelles entre les cellules de la peau et celles du cerveau. TCF4-et les échantillons témoins.
“Même sans microscope, il était possible de déterminer quel organoïde cérébral présentait la mutation”, a déclaré l’auteur principal de l’étude, Alysson R. Muotri, professeur à la faculté de médecine de l’UC San Diego, directeur du programme de cellules souches de l’UC San Diego et membre du Sanford Consortium for Regenerative Medicine.
Le site TCF4-Les organoïdes mutés étaient sensiblement plus petits que les organoïdes normaux, et de nombreuses cellules n’étaient pas réellement des neurones, mais des progéniteurs neuraux. Ces cellules simples sont censées se multiplier et devenir ensuite des cellules cérébrales spécialisées, mais dans les organoïdes mutés, une partie de ce processus s’était détraquée.
Une série d’expériences a révélé que les TCF4 a entraîné une dérégulation en aval de SOX et de la voie Wnt, deux signaux moléculaires importants qui guident les cellules embryonnaires vers la multiplication, la maturation en neurones et la migration vers le bon emplacement dans le cerveau.
En raison de ce dérèglement, les progéniteurs neuraux ne se sont pas multipliés efficacement, ce qui a entraîné une diminution du nombre de neurones corticaux. Les cellules qui sont devenues des neurones étaient moins excitables que la normale et restaient souvent groupées au lieu de s’organiser en circuits neuronaux finement réglés.
Cette architecture cellulaire atypique a perturbé le flux de l’activité neuronale dans l’organoïde cérébral muté, ce qui, selon les auteurs, contribuerait probablement à l’altération des fonctions cognitives et motrices à long terme.
“Nous avons été surpris de constater des problèmes de développement aussi importants à toutes ces échelles, et nous nous sommes demandés ce que nous pouvions faire pour y remédier”, a déclaré le premier auteur, Fabio Papes, PhD, professeur associé à l’Université de Campinas et chercheur invité à la faculté de médecine de l’UC San Diego, qui a supervisé les travaux avec Muotri. Fabio Papes a un parent atteint du syndrome de Pitt-Hopkins, ce qui l’a motivé à étudier le syndrome de Pitt-Hopkins. TCF4.
L’équipe a testé deux stratégies de thérapie génique différentes pourrécupérer le gène fonctionnel dans le tissu cérébral. Les deux méthodes ont effectivement augmenté TCF4 et, ce faisant, ont corrigé les phénotypes du syndrome de Pitt-Hopkins à l’échelle moléculaire, cellulaire et électrophysiologique.
“Le fait que nous puissions corriger ce seul gène et que l’ensemble du système neuronal se rétablisse, même à un niveau fonctionnel, est étonnant”, a déclaré Muotri.
Muotri note que ces interventions génétiques ont eu lieu à un stade prénatal du développement du cerveau, alors que dans un cadre clinique, les enfants recevraient leur diagnostic et leur traitement quelques années plus tard. Ainsi, les essais cliniques doivent d’abord confirmer si une intervention ultérieure est toujours sûre et efficace. L’équipe optimise actuellement ses outils de thérapie génique récemment homologués en vue d’un tel essai, dans lequel des injections rachidiennes du vecteur génétique permettraient de rétablir la fonction TCF4 dans le cerveau.
“Pour ces enfants et leurs proches, toute amélioration de la fonction motrice-cognitive et de la qualité de vie vaudrait la peine d’être tentée”, a déclaré M. Muotri.
“Ce qui est vraiment remarquable dans ce travail, c’est que ces chercheurs vont au-delà du laboratoire et travaillent dur pour que ces résultats puissent être appliqués en clinique”, a déclaré Audrey Davidow, présidente de la Pitt Hopkins Research Foundation. “C’est bien plus qu’un excellent article universitaire ; c’est une véritable mesure de ce que la science bien pratiquée peut accomplir pour améliorer la vie des gens.”
Référence : “La perte de fonction du facteur de transcription 4 est associée à des déficits dans la prolifération des progéniteurs et le contenu des neurones corticaux” par Fabio Papes, Antonio P. Camargo, Janaina S. de Souza, Vinicius M. A. Carvalho, Ryan A. Szeto, Erin LaMontagne, José R. Teixeira, Simoni H. Avansini, Sandra M. Sánchez-Sánchez, Thiago S. Nakahara, Carolina N. Santo, Wei Wu, Hang Yao, Barbara M. P. Araújo, Paulo E. N. F. Velho, Gabriel G. Haddad et Alysson R. Muotri, 2 mai 2022,Nature Communications.
DOI: 10.1038/s41467-022-29942-w
Les co-auteurs sont : Janaina S. de Souza, Ryan A. Szeto, Erin LaMontagne, Simoni H. Avansini, Sandra M. Sanchez-Sanchez, Wei Wu, Hang Yao et Gabriel Haddad à l’UC San Diego ; Antonio P. Camargo, Vinicius M. A. Carvalho, Jose R. Teixeira, Thiago S. Nakahara, Carolina N. Santo, Barbara M. P. Araujo et Paulo E. N. F. Velho à l’Université de Campinas.
Ce travail a été financé, en partie, par les National Institutes of Health (subvention R01 MH123828), la Pitt Hopkins Research Foundation, la Sao Paulo Research Foundation (subventions 2020/11451-7, 2018/03613-7, 2018/04240-0) et le Joint Genome Institute (DE-AC02-05CH11231) du ministère américain de l’Énergie.
Divulgations : Alysson R. Muotri est le cofondateur et détient une participation dans TISMOO, une société dédiée à l’analyse génétique et à l’organogenèse du cerveau humain.