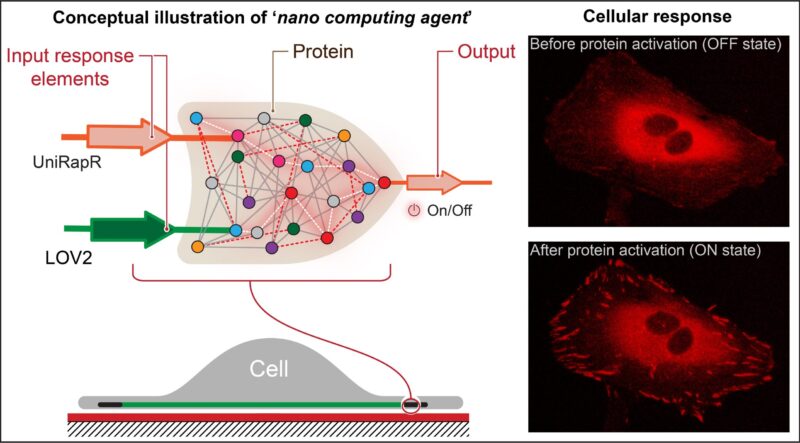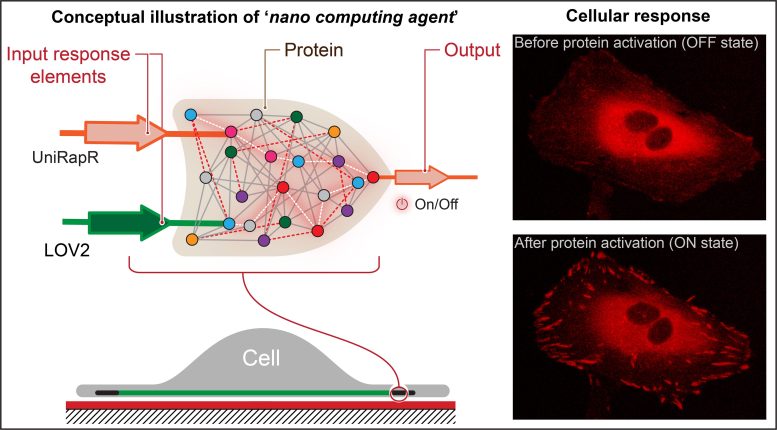
Les chercheurs ont créé une « porte logique » semblable à un transistor, qui est un type d’opération de calcul dans laquelle plusieurs entrées contrôlent une sortie et l’incorporent dans une protéine. Ils ont découvert que non seulement ils pouvaient activer rapidement la protéine à l’aide de la lumière et du médicament rapamycine, mais également que cette activation entraînait des modifications internes des cellules qui amélioraient leurs capacités adhésives, ce qui diminuait finalement leur motilité. Crédit : État de Pennsylvanie
La création d’ordinateurs à l’échelle nanométrique pour une utilisation dans les soins de santé de précision a longtemps été un rêve de nombreux scientifiques et prestataires de soins de santé. Maintenant, pour la première fois, des chercheurs de Penn State ont produit un agent nano-informatique qui peut contrôler la fonction d’une protéine particulière impliquée dans le mouvement cellulaire et les métastases cancéreuses. La recherche ouvre la voie à la construction d’ordinateurs nanométriques complexes pour la prévention et le traitement du cancer et d’autres maladies.
Nikolay Dokholyan, professeur G. Thomas Passananti, Penn State College of Medicine, et ses collègues – dont Yashavantha Vishweshwaraiah, chercheur postdoctoral en pharmacologie, Penn State – ont créé une « porte logique » semblable à un transistor, qui est un type d’opération informatique dans laquelle plusieurs entrées contrôlent une sortie.
“Notre porte logique n’est que le début de ce que vous pourriez appeler l’informatique cellulaire”, a-t-il déclaré, “mais c’est une étape majeure car elle démontre la capacité d’intégrer des opérations conditionnelles dans une protéine et de contrôler sa fonction”, a déclaré Dokholyan. « Cela nous permettra d’acquérir une compréhension plus approfondie de la biologie humaine et des maladies et présentera des possibilités de développement de thérapies de précision. »
La porte logique de l’équipe comprenait deux domaines de capteurs conçus pour répondre à deux entrées – la lumière et le médicament rapamycine. L’équipe a ciblé la protéine kinase d’adhésion focale (FAK) car elle est impliquée dans l’adhésion et le mouvement cellulaires, qui sont les premières étapes du développement du cancer métastatique.
“Tout d’abord, nous avons introduit un domaine sensible à la rapamycine, appelé uniRapr, que le laboratoire avait précédemment conçu et étudié, dans le gène qui code FAK”, a déclaré Vishweshwaraiah. « Ensuite, nous avons introduit le domaine, LOV2, qui est sensible à la lumière. Une fois que nous avons optimisé les deux domaines, nous les avons combinés dans une conception finale de porte logique.
L’équipe a inséré le gène modifié dans des cellules cancéreuses HeLa et, en utilisant la microscopie confocale, a observé les cellules in vitro. Ils ont étudié les effets de chacune des entrées séparément, ainsi que les effets combinés des entrées, sur le comportement des cellules.
Ils ont découvert que non seulement ils pouvaient activer rapidement FAK à l’aide de lumière et de rapamycine, mais également que cette activation entraînait des modifications internes des cellules qui amélioraient leurs capacités adhésives, ce qui diminuait finalement leur motilité.
Leurs résultats publiés aujourd’hui (16 novembre 2021) dans la revue Communication Nature.
“Nous montrons pour la première fois que nous pouvons construire un agent nano-informatique fonctionnel au sein de cellules vivantes qui peut contrôler le comportement cellulaire”, a déclaré Vishweshwaraiah. “Nous avons également découvert certaines caractéristiques intéressantes de la protéine FAK, telles que les changements qu’elle déclenche dans les cellules lorsqu’elle est activée.”
Dokholyan a noté que l’équipe espère éventuellement tester ces agents nano-informatiques in vivo au sein d’organismes vivants.
Référence : 16 novembre 2021, Communication Nature.
DOI : 10.1038/s41467-021-26937-x
D’autres auteurs de Penn State sur le papier incluent Jiaxing Chen, étudiant diplômé; Venkat R. Chirasani, stagiaire postdoctoral; et Erdem D. Tabdanov, professeur adjoint de pharmacologie.
Les National Institutes of Health et la Passan Foundation ont soutenu cette recherche.