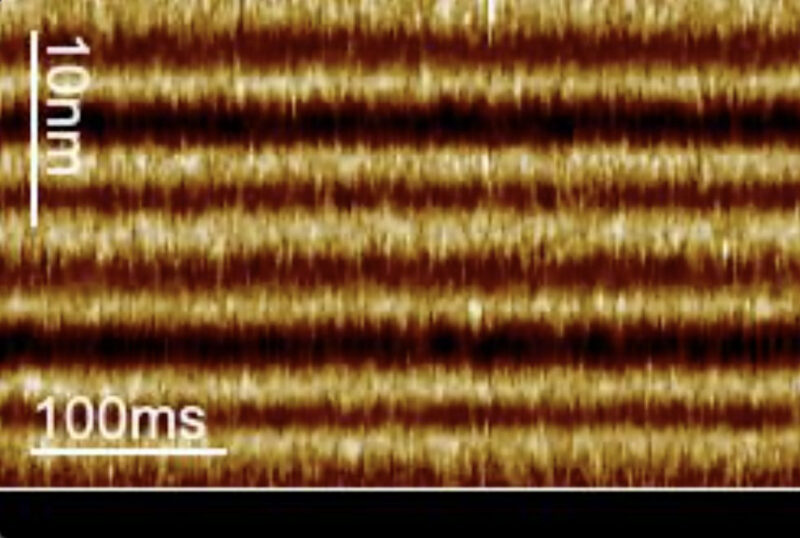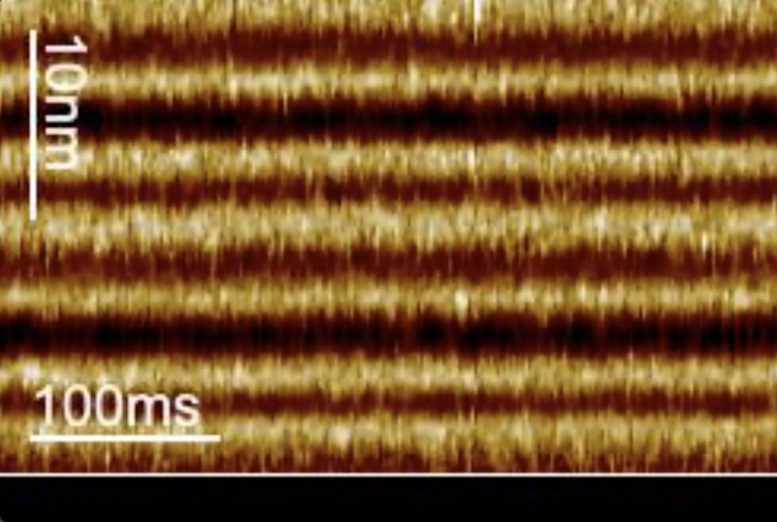
La microscopie à force atomique à balayage linéaire et à grande vitesse mesure le “déclenchement” de la protéine bactériorhodopsine avec une résolution temporelle de l’ordre de la milliseconde lorsque la lumière est allumée. La barre en bas du film indique que la lumière est éteinte (noir) et allumée (vert). Crédit : Image reproduite avec l’aimable autorisation du Dr Simon Scheuring et du Dr Alma Perez Perrino.
Grâce à une nouvelle technique d’imagerie innovante, des chercheurs de Weill Cornell Medicine ont révélé le fonctionnement interne d’une famille de molécules sensibles à la lumière avec une rapidité et des détails sans précédent. Ces travaux pourraient déboucher sur de nouvelles stratégies dans le domaine en plein essor de l’optogénétique, qui utilise des impulsions lumineuses pour modifier l’activité de neurones individuels et d’autres cellules.
Les protéines sensibles à la lumière pilotent de nombreux processus cruciaux en biologie, de la photosynthèse à la vision. La plupart des connaissances de la communauté scientifique sur ces protéines proviennent d’études sur la bactériorhodopsine, une protéine responsable de la photosynthèse chez certains organismes unicellulaires. Les chercheurs ont déjà résolu la structure tridimensionnelle de la bactériorhodopsine et étudié son activité en détail, mais les limites des techniques disponibles ont laissé des lacunes déroutantes dans les modèles obtenus.
La nouvelle étude, publiée dans le journal Nature Communicationsdécrit une technique développée par les chercheurs, appelée microscopie à force atomique à haute vitesse à balayage linéaire, qui capture les mouvements de la bactériorhodopsine en réponse à la lumière sur une échelle de temps de quelques millisecondes.
“La solution des structures protéiques est devenue assez simple”, a déclaré l’auteur principal, le Dr Simon Scheuring, professeur de physiologie et de biophysique en anesthésiologie à Weill Cornell Medicine. “Mais un défi actuel consiste à évaluer la cinétique, qui permet de comprendre le système de manière dynamique.”
En particulier, d’autres méthodes qui suivent l’activité de molécules individuelles fonctionnent trop lentement pour révéler comment la protéine change de forme sur de courtes périodes, comme la bactériorhodopsine semble le faire en réponse à la lumière. M. Scheuring compare ces techniques à une caméra à obturateur lent, qui pourrait capturer un oiseau se déplaçant rapidement d’un côté de l’écran puis de l’autre, mais serait incapable de le suivre entre ces deux points.
Jusqu’à présent, les chercheurs se sont attaqués à ce problème en handicapant l’oiseau : ils ont étudié des formes variantes de la bactériorhodopsine. “Jusqu’à présent, pour étudier la cinétique de la bactériorhodopsine, on utilisait des mutants plus lents”, explique l’auteur principal, le Dr Alma Perez Perrino, chercheur postdoctoral dans le laboratoire du Dr Scheuring. Mais les variantes plus lentes ne représentent pas l’activité normale de la protéine. Pour y remédier, le Dr Perez Perrino et ses collègues ont mis au point la microscopie à force atomique à balayage linéaire et à haute vitesse, qui sacrifie certains détails de l’image au profit d’une fréquence d’images beaucoup plus rapide, par exemple en prenant des images plus floues de l’oiseau afin de le suivre tout au long de l’écran.
“Nous suivons la protéine toutes les 1,6 millisecondes, ce qui nous permet d’explorer la vitesse de la bactériorhodopsine de type sauvage”, a déclaré le Dr Perez Perrino.
En réponse à la lumière, la bactériorhodopsine passe de l’état ouvert à l’état fermé. En utilisant leur technique d’imagerie plus rapide, les chercheurs ont découvert que la transition vers l’état ouvert et la durée de l’état ouvert se produisent toujours à la même vitesse, mais que la molécule reste à l’état fermé pendant des périodes plus longues à mesure que l’intensité de la lumière diminue.
Les chercheurs en optogénétique insèrent des gènes pour des molécules sensibles à la lumière dans les neurones ou d’autres cellules, ce qui leur permet de modifier le comportement des cellules par des impulsions lumineuses. Ces travaux ont révolutionné les neurosciences et offrent un potentiel pour le traitement des maladies neurologiques. Plus les chercheurs en sauront sur les protéines photo-sensibles, plus ils seront en mesure de pousser l’optogénétique loin. “En fin de compte, il s’agit d’activer un processus, d’en tirer le maximum et de pouvoir l’arrêter immédiatement”, a déclaré le Dr Scheuring. “Il est donc très important de connaître la cinétique des molécules pour cette commutation”.
Référence : “Cinétique de la molécule unique de bactériorhodopsine par HS-AFM” par Alma P. Perrino, Atsushi Miyagi et Simon Scheuring, 10 décembre 2021, Nature Communications.
DOI: 10.1038/s41467-021-27580-2