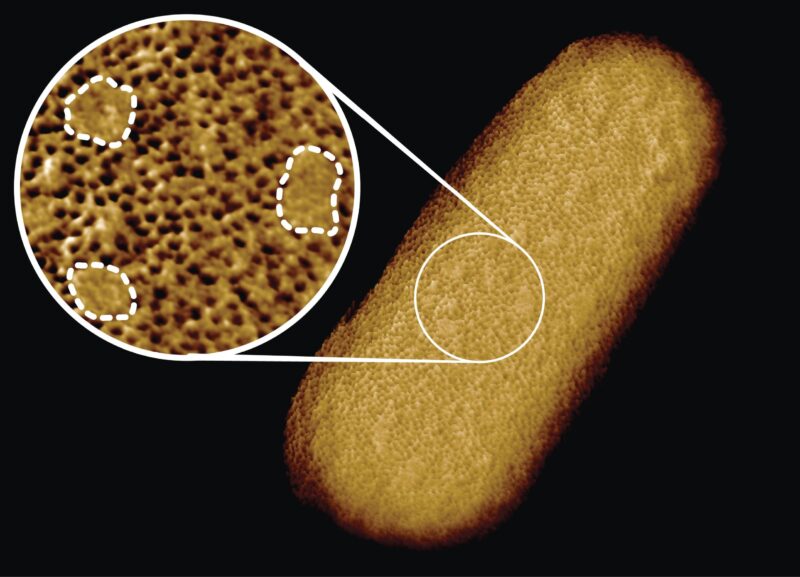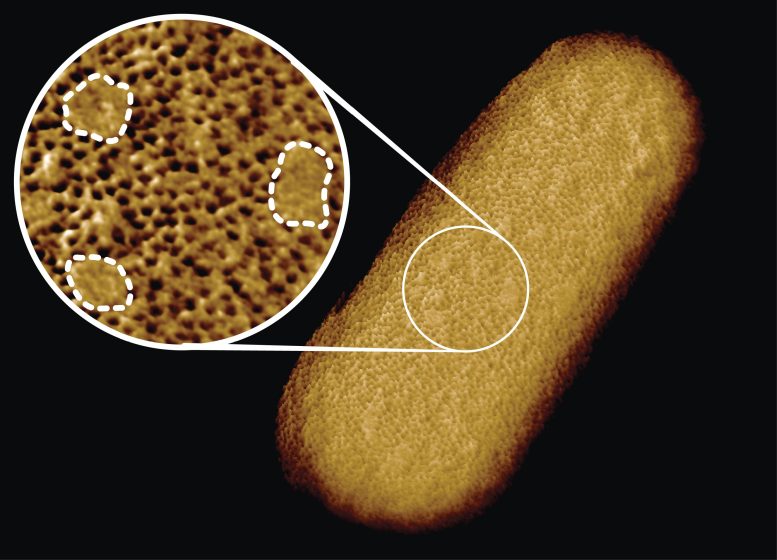
Image de microscopie d’une bactérie E. coli vivante, révélant la nature inégale de sa membrane externe protectrice. Un réseau dense de protéines est interrompu par des îlots lisses sans protéines (étiquetés par des lignes pointillées dans l’encart). Crédit : Benn et al. UCL
Les images les plus nettes jamais enregistrées de bactéries vivantes ont été enregistrées par des chercheurs de l’UCL, révélant l’architecture complexe de la couche protectrice qui entoure de nombreuses bactéries et les rend plus difficiles à tuer par les antibiotiques.
L’étude, publiée aujourd’hui (25 octobre 2021) dans Actes de l’Académie nationale des sciences des États-Unis et réalisé en collaboration avec des scientifiques du National Physical Laboratory, King’s College de Londres, Université d’Oxford, et université de Princeton, révèle que les bactéries dotées de couches externes protectrices – appelées bactéries à Gram négatif – peuvent avoir des points plus forts et plus faibles à leur surface.
L’équipe a découvert que la membrane externe protectrice de la bactérie contient des réseaux denses de blocs de construction protéiques alternés par des plaques qui ne semblent pas contenir de protéines. Au lieu de cela, ces patchs sont enrichis en molécules avec des chaînes sucrées (glycolipides) qui maintiennent la membrane externe étanche.
Il s’agit d’une découverte importante car la membrane externe résistante des bactéries Gram-négatives empêche certains médicaments et antibiotiques de pénétrer dans la cellule : cette membrane externe explique en partie pourquoi la résistance antimicrobienne de ces bactéries (y compris A. baumannii, P. aeruginosa, et les entérobactéries telles que Salmonelle et E. coli) est désormais considérée comme une menace plus importante que celle des bactéries Gram-positives telles que les bactéries résistantes S. aureus (bien connu sous le nom de SARM).
« La membrane externe est une formidable barrière contre les antibiotiques et est un facteur important pour rendre les bactéries infectieuses résistantes aux traitements médicaux. Cependant, il reste relativement peu clair comment cette barrière est constituée, c’est pourquoi nous avons choisi de l’étudier de manière aussi détaillée », a expliqué l’auteur correspondant, le professeur Bart Hoogenboom (London Center for Nanotechnology à l’UCL et UCL Physics & Astronomy).
« En étudiant les bactéries vivantes de l’échelle moléculaire à l’échelle cellulaire, nous pouvons voir comment les protéines membranaires forment un réseau qui s’étend sur toute la surface de la bactérie, laissant de petits espaces pour les patchs qui ne contiennent aucune protéine. Cela suggère que la barrière n’est peut-être pas aussi difficile à franchir ou à étirer sur toute la bactérie, mais peut avoir des points plus forts et plus faibles qui peuvent également être ciblés par les antibiotiques.
Pour mieux comprendre cette architecture, les scientifiques ont passé une petite aiguille sur la vie Escherichia coli (E. coli) bactéries, « sentant » ainsi leur forme générale. La pointe de l’aiguille n’ayant que quelques nanomètres de large, cela a permis de visualiser les structures moléculaires à la surface bactérienne.
Les images obtenues montrent que toute la membrane externe de la bactérie est bourrée de trous microscopiques formés par des protéines qui permettent l’entrée des nutriments tout en empêchant l’entrée des toxines. Bien que la membrane externe soit connue pour contenir de nombreuses protéines, cette nature encombrée et immobile était inattendue.
Étonnamment, les images ont également révélé de nombreux patchs qui ne semblaient pas contenir de protéines. Ces patchs contiennent un glycolipide normalement présent à la surface des bactéries à Gram négatif. De plus, un type différent de patch ressemblant à un bouton s’est formé lorsque des parties de la membrane ont été retournées à l’envers en raison de mutations. Dans ce cas, l’apparition de ces défauts était corrélée à une sensibilité accrue à la bacitracine, un antibiotique généralement efficace uniquement contre les bactéries Gram-positives, mais pas contre les bactéries Gram-négatives.
Comme l’a expliqué Georgina Benn, qui a effectué la microscopie sur les bactéries dans le laboratoire du professeur Hoogenboom à l’UCL : . Nos images démontrent que ce n’est pas le cas, mais que les plaques lipidiques sont séparées des réseaux riches en protéines, tout comme l’huile se sépare de l’eau, formant dans certains cas des interstices dans l’armure de la bactérie. Cette nouvelle façon de regarder la membrane externe signifie que nous pouvons maintenant commencer à explorer si et comment un tel ordre est important pour la fonction, l’intégrité et la résistance aux antibiotiques de la membrane.
L’équipe spécule également que les résultats peuvent aider à expliquer les moyens par lesquels les bactéries peuvent maintenir une barrière protectrice serrée tout en permettant une croissance rapide : la bactérie commune E. coli double de volume puis se divise en 20 minutes dans des conditions favorables. Ils suggèrent que les patchs glycolipidiques peuvent permettre plus d’étirement de la membrane que les réseaux de protéines, ce qui permet à la membrane de s’adapter plus facilement à la taille croissante de la bactérie.
Référence : « Phase separation in the external membrane of Escherichia coli » 25 octobre 2021, Actes de l’Académie nationale des sciences.
DOI : 10.1073/pnas.2112237118
Le travail a été aimablement financé par l’UKRI, les National Institutes of Health, le Conseil européen de la recherche et le ministère britannique des Affaires, de l’Énergie et de la Stratégie industrielle.