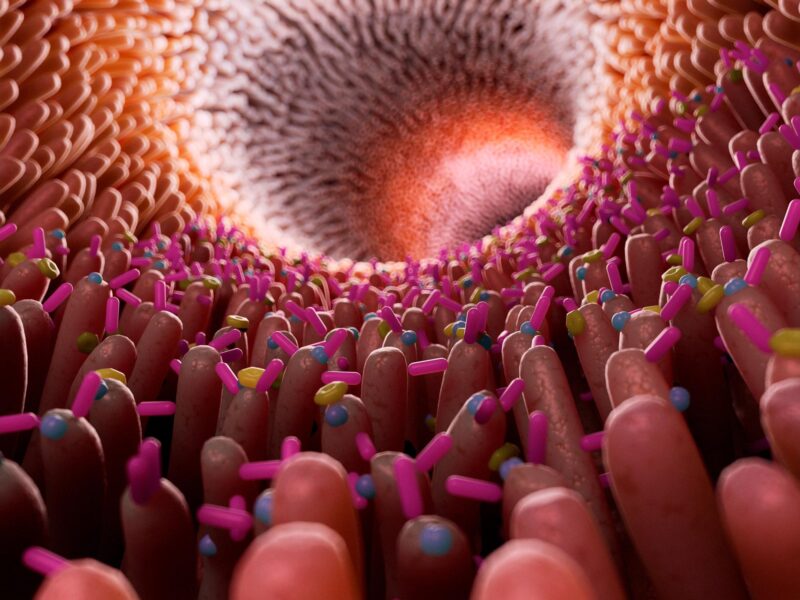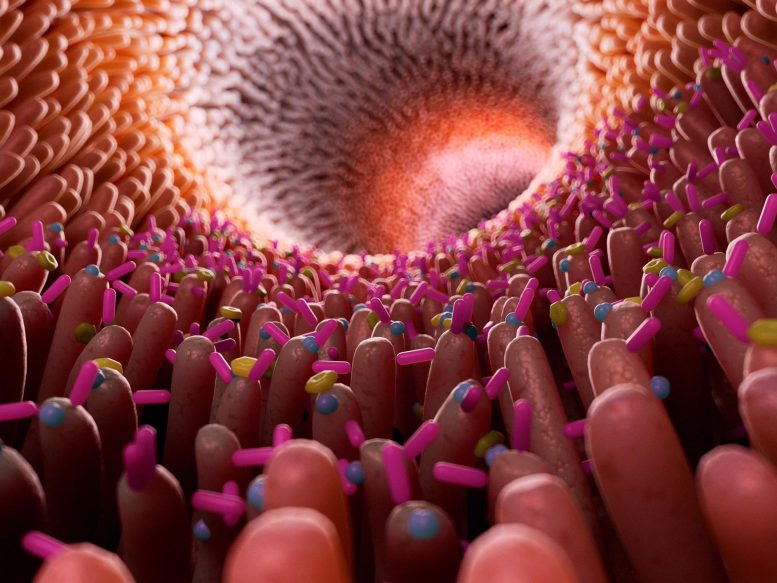
Illustration du microbiome intestinal humain.
Les microbes qui décomposent les antibiotiques en toute sécurité pourraient prévenir les infections opportunistes et réduire la propagation de la résistance aux antibiotiques.
Les antibiotiques sont des médicaments qui sauvent des vies, mais ils peuvent aussi nuire aux microbes bénéfiques qui vivent dans l’intestin humain. À la suite d’un traitement antibiotique, certains patients risquent de développer une inflammation ou des infections opportunistes telles que Clostridiodes difficile. L’utilisation indiscriminée d’antibiotiques sur les microbes intestinaux peut également contribuer à la propagation de la résistance aux médicaments.
Dans un effort pour réduire ces risques, MIT ingénieurs ont développé une nouvelle façon d’aider à protéger la flore naturelle du tube digestif humain. Ils ont pris une souche de bactérie sans danger pour la consommation humaine et l’ont modifiée pour qu’elle produise en toute sécurité une enzyme qui décompose une classe d’antibiotiques appelés bêta-lactames. Ceux-ci comprennent l’ampicilline, l’amoxicilline et d’autres médicaments couramment utilisés.
Lorsque ce “biothérapeutique vivant” est administré en même temps que des antibiotiques, il protège le microbiote de l’intestin mais permet aux niveaux d’antibiotiques circulant dans le sang de rester élevés, ont constaté les chercheurs dans une étude sur des souris.
“Ce travail montre que la biologie synthétique peut être exploitée pour créer une nouvelle classe de produits thérapeutiques conçus pour réduire les effets indésirables des antibiotiques”, déclare James Collins, titulaire de la chaire Termeer d’ingénierie et de sciences médicales à l’Institut d’ingénierie et de sciences médicales (IMES) et au Département d’ingénierie biologique du MIT, et auteur principal de la nouvelle étude.
Andres Cubillos-Ruiz PhD ’15, chercheur à l’IMES et au Wyss Institute for Biologically Inspired Engineering de l’Université de Harvard, est l’auteur principal de l’article, qui a été publié le 11 avril 2022 dans la revue . Nature Biomedical Engineering. Les autres auteurs sont Miguel Alcantar et Pablo Cardenas, étudiants diplômés du MIT, Nina Donghia, membre du personnel scientifique du Wyss Institute, et Julian Avila-Pacheco, chercheur au Broad Institute.
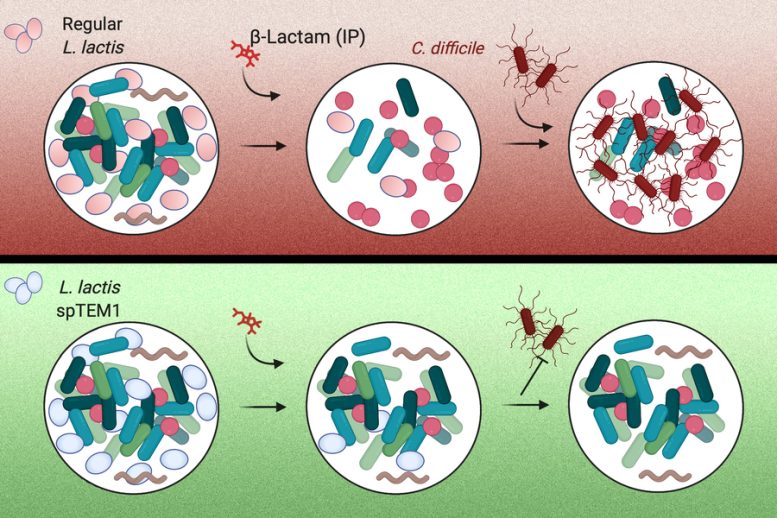
Les chercheurs du MIT ont mis au point une souche de bactérie, appelée L. lactis spTEM1 sur l’image, qui peut aider à protéger la flore naturelle du tube digestif humain contre les antibiotiques et prévenir le développement d’infections opportunistes telles que C. difficile. Crédit : avec l’aimable autorisation des chercheurs, édité par MIT News.
Protéger l’intestin
Au cours des deux dernières décennies, la recherche a révélé que les microbes de l’intestin humain jouent un rôle important non seulement dans le métabolisme, mais aussi dans la fonction immunitaire et le fonctionnement du système nerveux.
“Tout au long de votre vie, ces microbes intestinaux s’assemblent en une communauté très diversifiée qui remplit des fonctions importantes dans votre organisme”, explique Mme Cubillos-Ruiz. “Le problème survient lorsque des interventions telles que des médicaments ou des régimes alimentaires particuliers affectent la composition du microbiote et créent un état altéré, appelé dysbiose. Certains groupes microbiens disparaissent, tandis que l’activité métabolique d’autres groupes augmente. Ce déséquilibre peut entraîner divers problèmes de santé.”
Une complication majeure qui peut survenir est l’infection de C. difficileun microbe qui vit couramment dans l’intestin mais qui n’est généralement pas dangereux. Lorsque les antibiotiques éliminent les souches qui entrent en compétition avec le C. difficile ils peuvent provoquer une infection. C. difficileCependant, cette bactérie peut prendre le dessus et provoquer des diarrhées et des colites. C. difficile infecte environ 500 000 personnes chaque année aux États-Unis, et provoque environ 15 000 décès.
Les médecins prescrivent parfois des probiotiques (mélanges de bactéries bénéfiques) aux personnes qui prennent des antibiotiques, mais ces probiotiques sont généralement sensibles aux antibiotiques et ne reproduisent pas complètement le microbiote naturel de l’intestin.
“Les probiotiques standard ne peuvent pas se comparer à la diversité des microbes indigènes”, explique Mme Cubillos-Ruiz. “Ils ne peuvent pas accomplir les mêmes fonctions que les microbes natifs que vous avez nourris tout au long de votre vie.”
Pour protéger le microbiote des antibiotiques, les chercheurs ont décidé d’utiliser des bactéries modifiées. Ils ont créé une souche de bactérie appelée Lactococcus lactisqui est normalement utilisée dans la production de fromage, afin de produire une enzyme qui décompose les antibiotiques bêta-lactames. Ces médicaments représentent environ 60 % des antibiotiques prescrits aux États-Unis.
Lorsque ces bactéries sont administrées par voie orale, elles peuplent transitoirement les intestins, où elles sécrètent l’enzyme, appelée bêta-lactamase. Cette enzyme décompose alorsles antibiotiques qui atteignent le tractus intestinal. Lorsque les antibiotiques sont administrés par voie orale, les médicaments pénètrent dans la circulation sanguine principalement par l’estomac, de sorte qu’ils peuvent encore circuler dans l’organisme à des niveaux élevés. Cette approche pourrait également être utilisée avec les antibiotiques injectés, qui finissent également par atteindre l’intestin. Une fois leur travail terminé, les bactéries modifiées sont excrétées par le tube digestif.
L’utilisation de bactéries modifiées qui dégradent les antibiotiques pose des exigences de sécurité uniques : Les enzymes bêta-lactamases confèrent une résistance aux antibiotiques aux cellules qui les hébergent et leurs gènes peuvent facilement se propager entre différentes bactéries. Pour y remédier, les chercheurs ont utilisé une approche de biologie synthétique pour recoder la façon dont la bactérie synthétise l’enzyme. Ils ont divisé le gène de la bêta-lactamase en deux parties, chacune codant pour un fragment de l’enzyme. Ces segments de gènes sont situés sur différents morceaux de ADNIl est donc très peu probable que les deux segments de gènes soient transférés à une autre cellule bactérienne.
Ces fragments de bêta-lactamase sont exportés à l’extérieur de la cellule où ils se réassemblent, restaurant ainsi la fonction enzymatique. Comme la bêta-lactamase est maintenant libre de se diffuser dans le milieu environnant, son activité devient un “bien public” pour les communautés bactériennes intestinales. Cela empêche les cellules modifiées de prendre l’avantage sur les microbes intestinaux natifs.
“Notre stratégie de confinement biologique permet d’administrer des enzymes dégradant les antibiotiques dans l’intestin sans risque de transfert horizontal de gènes à d’autres bactéries ou d’acquisition d’un avantage concurrentiel supplémentaire par le produit biothérapeutique vivant”, explique M. Cubillos-Ruiz.
Maintenir la diversité microbienne
Pour tester leur approche, les chercheurs ont administré aux souris deux doses orales de la bactérie modifiée pour chaque injection d’ampicilline. Les bactéries modifiées ont atteint l’intestin et ont commencé à libérer de la bêta-lactamase. Chez ces souris, les chercheurs ont constaté que la quantité d’ampicilline circulant dans le sang était aussi élevée que chez les souris qui n’avaient pas reçu la bactérie modifiée.
Dans l’intestin, les souris qui ont reçu des bactéries modifiées ont maintenu un niveau de diversité microbienne beaucoup plus élevé que les souris qui ont reçu uniquement des antibiotiques. Chez ces dernières, le niveau de diversité microbienne a chuté de façon spectaculaire après l’administration d’ampicilline. En outre, aucune des souris ayant reçu les bactéries modifiées n’a développé de maladies opportunistes. C. difficile alors que toutes les souris qui n’ont reçu que des antibiotiques ont présenté des niveaux élevés d’infections à C. difficile .C. difficiledans l’intestin.
“C’est une démonstration solide que cette approche peut protéger le microbiote intestinal, tout en préservant l’efficacité de l’antibiotique, car vous ne modifiez pas les niveaux dans la circulation sanguine”, dit Cubillos-Ruiz.
Les chercheurs ont également constaté que l’élimination de la pression évolutive du traitement antibiotique rendait beaucoup moins probable le développement d’une résistance aux antibiotiques par les microbes de l’intestin après le traitement. En revanche, ils ont trouvé de nombreux gènes de résistance aux antibiotiques dans les microbes qui ont survécu chez les souris ayant reçu des antibiotiques mais pas les bactéries modifiées. Ces gènes peuvent être transmis à des bactéries nuisibles, ce qui aggrave le problème de la résistance aux antibiotiques.
Les chercheurs prévoient maintenant de commencer à développer une version du traitement qui pourrait être testée chez les personnes présentant un risque élevé de développer des maladies aiguës résultant d’une dysbiose intestinale induite par les antibiotiques. Ils espèrent qu’à terme, ce traitement pourrait être utilisé pour protéger toute personne devant prendre des antibiotiques pour des infections extérieures à l’intestin.
“Si l’action de l’antibiotique n’est pas nécessaire dans l’intestin, alors vous devez protéger le microbiote. C’est un peu comme lorsque vous passez une radiographie, vous portez un tablier en plomb pour protéger le reste de votre corps des rayonnements ionisants”, explique Cubillos-Ruiz. “Aucune intervention antérieure ne pouvait offrir ce niveau de protection. Avec notre nouvelle technologie, nous pouvons rendre les antibiotiques plus sûrs en préservant les microbes intestinaux bénéfiques et en réduisant les risques d’émergence de nouvelles variantes résistantes aux antibiotiques.”
Pour plus d’informations sur cette recherche, voir Engineered Live Biotherapeutic protège votre microbiome intestinal des antibiotiques.
Référence : “An engineered live biotherapeutic for the prevention of antibiotic-induced dysbiosis” par Andrés Cubillos-Ruiz, Miguel A. Alcantar, Nina M. Donghia, Pablo Cárdenas, Julian Avila-Pacheco et James J. Collins, 11 avril 2022,Nature Biomedical Engineering.
DOI: 10.1038/s41551-022-00871-9
Cette recherche a été financée par la Defense Threat Reduction Agency, le Paul G. Allen Frontiers Group, le Wyss Institute et une bourse de recherche de la National Science Foundation.fraternité.