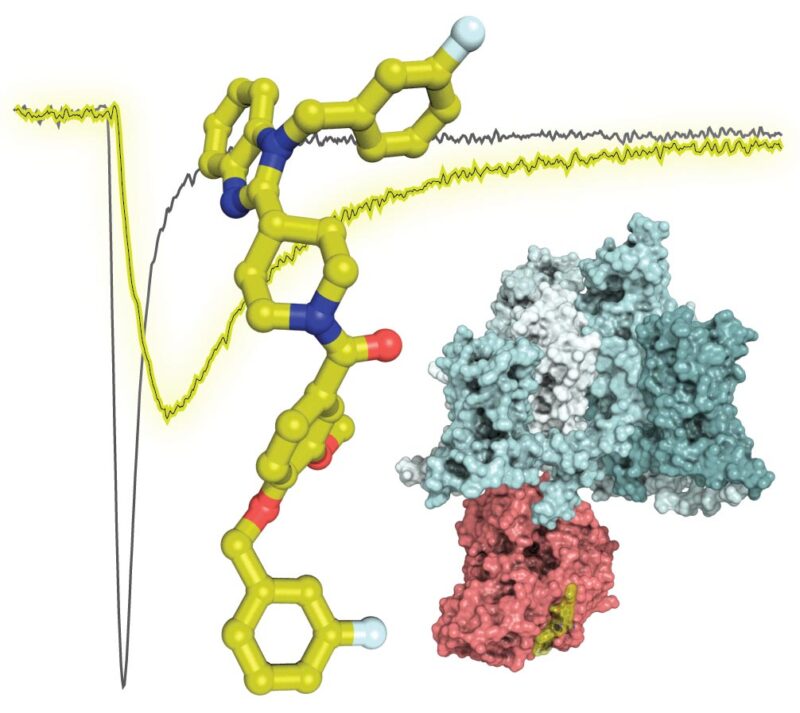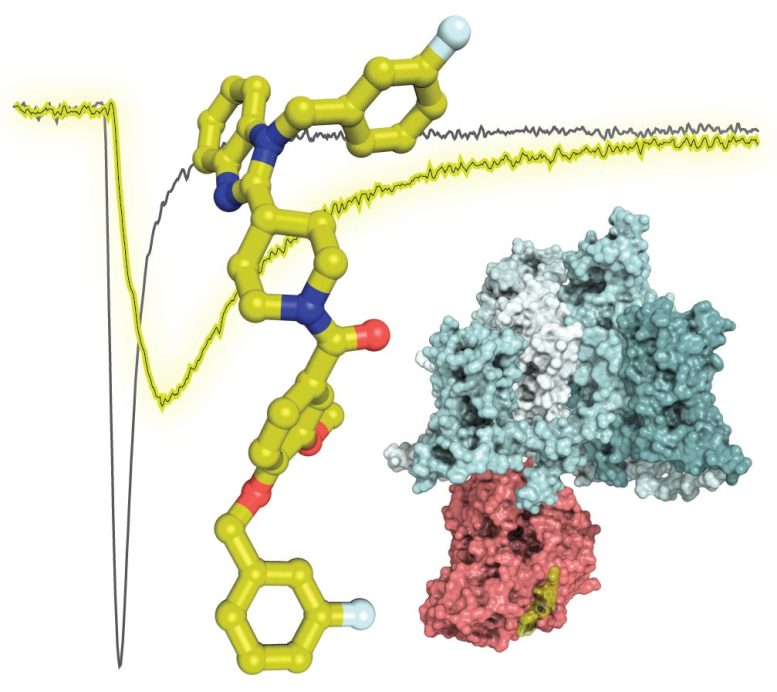
Cette image montre la structure du composé 194 (bâtons jaunes) superposée sur une trace électrophysiologique montrant des courants de sodium réduits (lignes jaunes par rapport aux lignes noires) des cellules traitées avec le composé 194. La structure illustre l’interaction prévue de CRMP2 (rose, PDB 2GSE ) avec le canal Nav1.7 (cyan, PDB 6J8G). Crédit : Sciences de la santé de l’Université de l’Arizona
Les chercheurs ont ciblé un canal ionique sodium commun pour inverser la douleur, avec des résultats positifs qui pourraient conduire à une solution non addictive pour traiter la douleur.
Des chercheurs de l’Université des sciences de la santé de l’Arizona sont sur le point de développer un analgésique non opioïde sûr et efficace après qu’une étude a montré qu’un nouveau composé qu’ils ont créé réduit la sensation de douleur en régulant un canal biologique lié à la douleur.
La plupart des gens ressentent de la douleur à un moment donné de leur vie, et les National Institutes of Health estiment que 100 millions de personnes aux États-Unis souffrent de douleur chronique. Selon le National Institute on Drug Abuse, environ 21 à 29 % des patients auxquels on a prescrit des opioïdes pour la douleur chronique en font un mauvais usage et 8 à 12 % des personnes qui utilisent un opioïde pour la douleur chronique développent un trouble lié à la consommation d’opioïdes. En 2019, près de 50 000 personnes aux États-Unis sont décédées d’overdoses liées aux opioïdes.
« La découverte de médicaments contre la douleur chronique est au premier plan de cette recherche, et elle est amplifiée par l’intersection de la COVID-19[feminine pandémie et l’épidémie d’opioïdes », a déclaré Rajesh Khanna, PhD, directeur associé du UArizona Health Sciences Comprehensive Pain and Addiction Center et professeur de pharmacologie au UArizona College of Medicine – Tucson. « La découverte de médicaments est un processus très ardu. Notre laboratoire a examiné un mécanisme fondamental de la douleur, a trouvé un moyen de le différencier de ceux qui nous ont précédés et a trouvé un composé qui a le potentiel en tant que nouveau traitement non opioïde de la douleur.

Rajesh Khanna, PhD, est directeur associé du Comprehensive Pain and Addiction Center des sciences de la santé de l’Université de l’Arizona et professeur de pharmacologie au UArizona College of Medicine – Tucson. Crédit : Sciences de la santé de l’Université de l’Arizona/Kris Hanning
L’article, “Le ciblage sélectif du NaV1.7 via l’inhibition de l’interaction CRMP2-Ubc9 réduit la douleur chez les rongeurs”, a été publié aujourd’hui (10 novembre 2021) dans Science Médecine translationnelle.
Le mécanisme biologique au cœur de la recherche est le NaV1.7, un canal ionique sodium qui était auparavant lié à la sensation de douleur grâce à des études génétiques sur des personnes souffrant de troubles douloureux rares.
Les cellules nerveuses, ou neurones, utilisent des courants électriques pour envoyer des signaux au cerveau et dans tout le corps, et les canaux ioniques sodium sont essentiels à la capacité d’une cellule à générer ces courants électriques. Lorsqu’un neurone est stimulé, le canal NaV1.7 s’ouvre et permet aux ions sodium chargés positivement de traverser la membrane cellulaire et d’entrer dans la cellule précédemment chargée négativement. Le changement de charge à travers la membrane cellulaire génère un courant électrique, qui augmente l’excitabilité du neurone et déclenche une cascade d’événements qui entraînent la douleur.
Étant donné que NaV1.7 est une cible validée par l’homme pour la douleur, plusieurs tentatives ont tenté d’arrêter la douleur en utilisant des inhibiteurs des canaux ioniques sodium pour bloquer NaV1.7. Aucun n’a réussi. Le Dr Khanna et son équipe ont adopté une approche différente – plutôt que de bloquer le NaV1.7, ils voulaient le réguler indirectement.
À l’aide d’un composé qu’ils ont conçu et baptisé 194, l’équipe a réussi à réguler l’activation du NaV1.7 en laboratoire à l’aide de cellules nerveuses de quatre espèces différentes, dont l’homme. Dans les modèles animaux, 194 était efficace pour inverser la douleur dans six modèles de douleur différents chez les deux sexes.
Les chercheurs ont également découvert que 194 peut également favoriser le soulagement de la douleur en activant le système opioïde endogène ou naturel du corps. Une fois produits, les opioïdes endogènes activent des récepteurs qui produisent des changements physiologiques tels que le soulagement de la douleur. Et 194 l’ont fait sans causer de problèmes de performance motrice, de comportements dépressifs ou de dépendance.
Enfin, le Dr Khanna et son équipe ont observé un effet synergique lorsque le 194 était combiné avec de la morphine et de la gabapentine. C’est un signe prometteur que le 194 pourrait également être utilisé dans une stratégie de réduction de dose pour les analgésiques qui ont des effets secondaires négatifs, y compris les opioïdes, tout en maintenant des niveaux élevés de soulagement de la douleur.
La science derrière 194
Les recherches antérieures du Dr Khanna ont identifié une protéine, la protéine médiateur de la réponse à la collapsine 2 (CRMP2), et une enzyme, Ubc9, qui jouent toutes deux un rôle dans l’activation du NaV1.7. CRMP2 est une protéine qui se lie au NaV1.7 et le transporte jusqu’à la membrane cellulaire, où les ions sodium sont ensuite transférés dans la cellule. Ubc9 est une enzyme qui marque CRMP2 avec une autre protéine – une petite protéine modificatrice de type ubiquitine – pour contrôler spécifiquement le NaV1.7.
S’appuyant sur ces connaissances, le Dr Khanna et son équipe ont cherché à déterminer s’ils pouvaient réguler directement l’activité de NaV1.7 en empêchant Ubc9 d’interagir avec CRMP2. Les membres de l’équipe, dont May Khanna, PhD, professeur agrégé de pharmacologie et membre de l’Institut BIO5, Vijay Gokhale, PhD, professeur agrégé de recherche à l’Institut BIO5, et Samantha Perez-Miller, PhD, chercheuse et scientifique au Département de pharmacologie, ont examiné 50 000 petites molécules pour identifier celles ayant une structure similaire à Ubc9.
Ils ont sélectionné moins de 50 des correspondances les plus proches, qui ont ensuite été testées dans le laboratoire du Dr Khanna pour voir si leur présence supprimerait l’afflux de sodium via NaV1.7. Les résultats étant prometteurs, l’équipe s’est fixée pour objectif de développer un composé unique et plus efficace.
Le résultat a été 194, que l’UArizona a breveté et autorisé à démarrer Regulonix LLC par l’intermédiaire de Tech Launch Arizona, le bureau de l’UArizona qui commercialise les inventions issues de la recherche universitaire. Drs. Khanna et Gokhale ont fondé Regulonix LLC en 2016 pour lutter contre l’épidémie croissante d’opioïdes en développant de nouveaux moyens non addictifs de traiter la douleur et en commercialisant ces innovations.
Alors que 194 est très prometteur pour le soulagement de la douleur, le Dr Khanna et son équipe ont travaillé avec le National Institutes of Health’s National Center for Advancing Translational Sciences pour optimiser le composé. Dans ce cas, une équipe NCATS se concentre principalement sur l’amélioration de la demi-vie du 194 – le temps qu’il faut pour qu’un médicament réduise de moitié dans votre corps – et ses propriétés similaires à celles d’un médicament.
Il s’agit d’une étape importante pour optimiser le potentiel du composé en tant que médicament antidouleur et passer à l’étape suivante, où les chercheurs déposeront l’approbation de la Food and Drug Administration pour commencer les essais cliniques.
Référence : « Ciblage sélectif du NaV1.7 via l’inhibition de l’interaction CRMP2-Ubc9 réduit la douleur chez les rongeurs » 10 novembre 2021, Science Médecine translationnelle.