L’auteur de l’étude, Jingru Sun, sort une fiole de bactéries d’un réfrigérateur dans son laboratoire de recherche. Crédit : Washington State University
Des recherches menées par des scientifiques de l’Université de l’État de Washington soutiennent une nouvelle théorie selon laquelle le système immunitaire inné dont les gens sont dotés à la naissance peut répondre différemment à des agents pathogènes spécifiques. Cette qualité, connue sous le nom de spécificité immunologique, était auparavant attribuée uniquement au système immunitaire adaptatif, qui se développe au fil du temps par l’exposition à la maladie.
Publié dans le journal Cell Reportsl’étude suggère que cette spécificité immunitaire innée est dirigée par le système nerveux et identifie une protéine neuronale comme un lien critique dans le processus.
Basés sur un modèle animal, ces résultats sont prometteurs pour le traitement de maladies telles que la septicémie, l’arthrite et les maladies inflammatoires de l’intestin, dans lesquelles le système immunitaire inné attaque l’organisme et provoque une inflammation incontrôlée. Ils pourraient également servir de base à la mise au point d’un traitement expérimental qui exploite le système nerveux pour combattre l’infection.

L’auteur de l’étude, Jingru Sun, utilise un microscope à micro-injection pour créer des C. elegans génétiquement modifiés pour une expérience. Crédit : Washington State University
“Des études cliniques ont montré que la stimulation de circuits neuronaux défectueux, que ce soit par voie électrique ou pharmacologique, peut guérir ou atténuer de nombreuses maladies immunitaires innées”, a déclaré Jingru Sun, co-auteur principal de l’étude et professeur associé au WSU Elson S. Floyd College of Medicine. “Savoir comment le système immunitaire inné génère une réponse spécifique à un pathogène particulier nous permet de manipuler les circuits neuronaux pour ajuster l’intensité de la réponse immunitaire selon les besoins.”
Cela permettrait essentiellement de rétablir l’équilibre du système immunitaire, soit en réduisant une réponse excessive qui peut provoquer une inflammation prolongée, des lésions tissulaires et même la mort, soit en renforçant une réponse insuffisante pour empêcher une infection de s’aggraver. Sun a déclaré que ce dernier point est particulièrement important étant donné que “l’ère post-antibiotique” approche à grands pas – une époque où les antibiotiques existants seront inutiles dans la lutte contre les superbactéries résistantes aux médicaments.
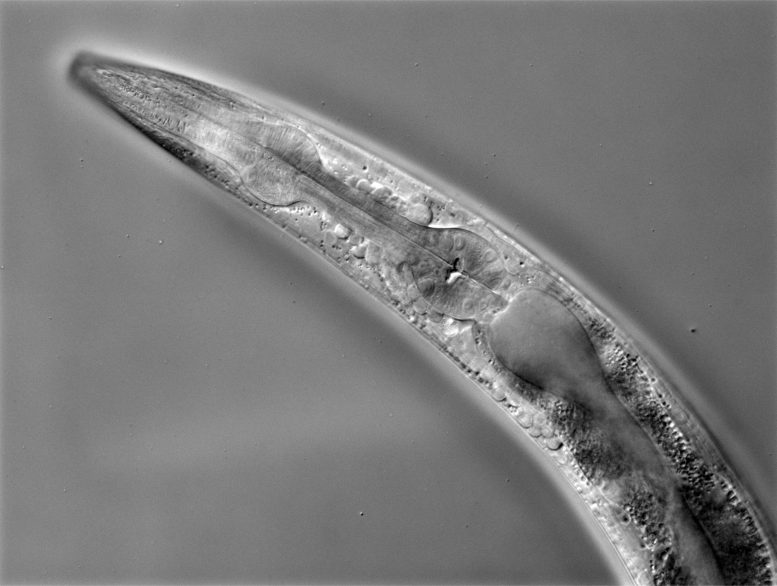
C. elegans vu sous un microscope à haute résolution. Crédit : Image par Phillip Wibisono
La recherche a été menée sur un minuscule ver connu sous le nom de Caenorhabditis elegans (C. elegans) qui se nourrit de bactéries dans le sol. C. elegans est un animal modèle couramment utilisé pour étudier la régulation neuronale de l’immunité innée en raison de la simplicité de son système nerveux, qui ne compte que 302 neurones bien identifiés – contre 86 milliards de neurones dans un cerveau humain – et de la transparence de son corps, qui permet aux scientifiques de voir comment différents gènes sont exprimés. De plus, contrairement à l’homme, C. elegans ne possède pas de système immunitaire adaptatif, ce qui permet d’étudier la spécificité de son système immunitaire inné sans interférence des réponses immunitaires adaptatives.
Les études initiales de l’équipe de la WSU ont révélé que l’absence d’une protéine réceptrice neuronale connue sous le nom de NMUR-1 avait des effets variables sur la survie de C. elegans lorsqu’il était exposé à différents pathogènes bactériens, ce qui indique que NMUR-1 pourrait être le médiateur de la spécificité de la réponse immunitaire innée à l’infection. Des tests supplémentaires avec deux bactéries qui ont montré des effets opposés sur la survie – c’est-à-dire une durée de vie plus longue et plus courte – ont confirmé que NMUR-1 dirige la spécificité de l’immunité innée et ont également révélé comment la protéine dirige différentes réponses à différents pathogènes.
“Ce que nous avons découvert, c’est que NMUR-1 contrôle les facteurs de transcription, qui à leur tour contrôlent la transcription de gènes distincts de l’immunité innée en réponse à différents pathogènes”, a déclaré le co-auteur principal Yiyong Liu, professeur adjoint au WSU Elson S. Floyd College of Medicine et directeur du Genomics Service Center de l’université.
Le premier auteur, Phillip Wibisono, un étudiant diplômé de WSU, a déclaré que les prochaines étapes de cette recherche consistent à identifier les circuits neuraux dont font partie les NMUR-1, puis à traiter ces circuits neuraux pour voir comment cela modifie la réponse immunitaire à différents pathogènes. En cas de succès, cela rapprocherait leurs travaux d’applications potentielles dans le traitement humain.
Référence : “Le RCPG neuronal NMUR-1 régule des réponses immunitaires distinctes à différents pathogènes” 8 février 2022, Rapports de cellules.
DOI: 10.1016/j.celrep.2022.110321
En plus de Sun, Liu et Wibisono, les co-auteurs de l’article sont Shawndra Wibisono, Chia-Hui Chen et Durai Sellegounder du WSU Elson S. Floyd College ofMédecine, et Jan Watteyne et Isabel Beets à la KU Leuven en Belgique.
L’étude a été soutenue par le National Institute of General Medical Sciences, une composante des National Institutes of Health, avec des fonds supplémentaires fournis par la Research Foundation Flanders et le WSU Elson S. Floyd College of Medicine.