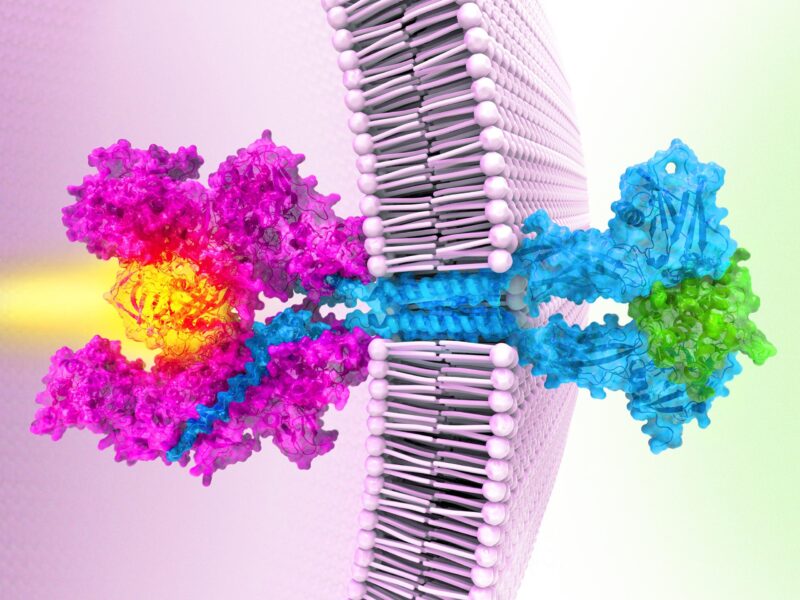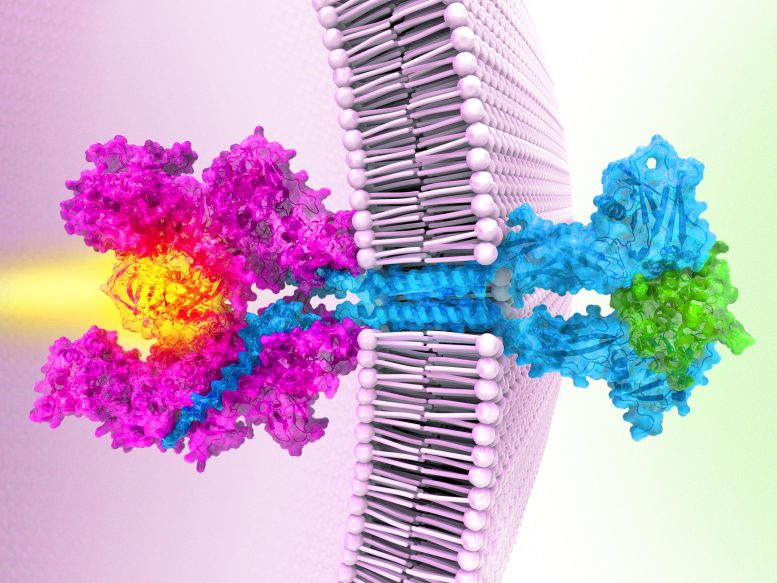
Lorsqu’une cytokine (en vert) se lie à des récepteurs (en sarcelle), deux parties de la protéine Janus kinase (en rose) se réunissent, l’activant pour envoyer des signaux à l’intérieur d’une cellule. Dans certains cancers, des mutations de la kinase la verrouillent, la maintenant anormalement active. Crédit : Eric Smith/Chris Garcia/Howard Hughes Medical Institute
La découverte a eu lieu le jour de l’anniversaire du biologiste moléculaire Christopher Garcia.
Depuis plus de 20 ans, son équipe et d’autres dans le monde entier poursuivaient une carrière insaisissable – la structure 3D d’une protéine de signalisation cruciale dans les cellules. Fin 2021, les images de la molécule prises au microscope électronique ont commencé à se préciser. Le 8 décembre, le post-doctorant Naotaka Tsutsumi et l’étudiant diplômé Caleb Glassman lui ont envoyé un courriel contenant une image étonnamment claire de la protéine accrochée à un récepteur clé. “J’étais en réunion et j’ai réalisé que nous l’avions”, se souvient Garcia, chercheur à l’Institut médical Howard Hughes de l’université de Stanford. “J’ai immédiatement quitté la réunion et couru au laboratoire.”
Glassman, qui venait de déménager à Boston pour un postdoc à Harvard, a annulé son voyage prévu dans l’arrière-pays et s’est précipité à Stanford. “Je voulais terminer ce que Naotaka et moi avions commencé”, explique-t-il. Les trois chercheurs ont ensuite travaillé jour et nuit pour déterminer la structure complète de la protéine, connue sous le nom de Janus kinase, et ont devancé les laboratoires concurrents pour cette découverte. “C’était une grande course de chevaux entre de nombreux groupes de premier plan dans le monde entier, et nous avons sprinté vers la ligne d’arrivée”, explique M. Garcia. Le 26 décembre, ils ont envoyé en urgence un manuscrit au journal Sciencequi a publié les travaux le 10 mars 2022.
L’équipe de Garcia a mis la main non seulement sur la structure complète d’une molécule de signalisation d’importance vitale, mais aussi sur le mécanisme de fonctionnement de ces kinases, qui était “une question fondamentale en biologie”, déclare John O’Shea, immunologiste aux National Institutes of Health, qui a contribué à la mise au point de l’un des premiers médicaments destinés à bloquer la fonction de la Janus kinase et qui n’a pas participé aux nouvelles recherches. Étant donné que les protéines peuvent se dérégler en cas de maladie, les résultats pourraient conduire à de nouveaux médicaments plus efficaces contre certains cancers. “C’est un travail extraordinaire”, dit O’Shea.
Un travail de longue haleine
Les kinases Janus sont l’un des moteurs de la communication du règne animal. Elles reçoivent des signaux provenant de l’extérieur des cellules et transmettent l’information aux molécules à l’intérieur. Les scientifiques savent depuis des années que le mauvais fonctionnement des kinases Janus peut provoquer des maladies. Certaines mutations qui altèrent les Janus kinases peuvent gravement réduire la capacité de l’organisme à lutter contre les infections, provoquant un état pratiquement identique à la “maladie du garçon bulle”. Et lorsque les anomalies génétiques et les signaux exagérés stimulent trop les kinases, il peut en résulter des cancers du sang comme la leucémie, ainsi que des maladies allergiques ou auto-immunes.
Les chercheurs connaissaient la forme de certaines parties des protéines, notamment les régions enzymatiques et régulatrices situées à l’extrémité de la molécule, ce qui leur a valu le nom de Janus kinases, d’après le dieu romain mythologique à deux visages. Des cribles médicamenteux sophistiqués ont permis de découvrir des molécules qui inhibent ces protéines, offrant aux médecins un moyen de traiter certains cancers et des troubles tels que la polyarthrite rhumatoïde. Mais les scientifiques ont développé ces médicaments sans connaître la structure complète des molécules ni la manière dont elles sont activées. Ainsi, la plupart de l’arsenal actuel de près d’une douzaine de médicaments, plus d’autres en cours d’essais cliniques, sont des instruments relativement émoussés, bloquant à la fois les kinases Janus saines et mutées. Ils peuvent néanmoins traiter de nombreuses maladies, de eczema to COVID-19, but also can cause a range of side effects.
Garcia wanted a more detailed view of the proteins but, as he learned when he first tried to image the molecules as a postdoc in 1995, it was a daunting challenge. The kinases are notoriously difficult to make in the lab. And they don’t easily form crystals, which scientists need to capture 3D structures using x-ray crystallography. So, for many years, Garcia and others could only view bits of the kinases at a time. “We kept chipping away without much to show for it,” he says.
In the last few years, the pieces began to fall into place. One key advance was a method called cryo-EM, where scientists freeze samples and then view them using an electron microscope. Another was the choice by Garcia’s team to study a mouse Janus kinase rather than a less stable human one. They also introduced a common cancer-causing mutation into the mouse kinase, which stabilized the molecule even further.
Lighting a fire
Garcia’s team’s work reveals the structure of a Janus kinase called JAK1 and outlines the steps it uses to sends signals within cells.
First, receptor proteins stud cell membranes, poking from the inner and outer surfaces of the cell like a toothpick through a sandwich. Then, a single Janus kinase inside the cell attaches to the receptors, waiting for a signal. Next, molecules called cytokines approach the cell’s exterior, each binding to two receptors. The cytokines act like a bridge that pulls the two receptors even closer, Garcia explains. That brings the active ends of the Janus kinase together, switching them on. Like a match lighting a fire, the kinase relays a signal that tells genes to turn on or off.
The structure also reveals how the cancer-causing mutation short-circuits this messaging chain – by gluing two parts of the Janus kinase together. That causes the two active regions to stay switched on even when there are no outside cytokines, sparking uncontrolled activity that can trigger cancers.
Garcia hopes the new results could help scientists design better drugs that target only defective Janus kinases, allowing healthy versions to keep performing their normal duties. The work, he says, is an example of an “ideal situation in science, where solving a basic problem also has direct relevance for disease.”
Reference: “Structure of a Janus kinase cytokine receptor complex reveals the basis for dimeric activation” by Caleb R. Glassman, Naotaka Tsutsumi, Robert A. Saxton, Patrick J. Lupardus, Kevin M. Jude and K. Christopher Garcia, 10 March 2022, Science.
DOI: 10.1126/science.abn8933