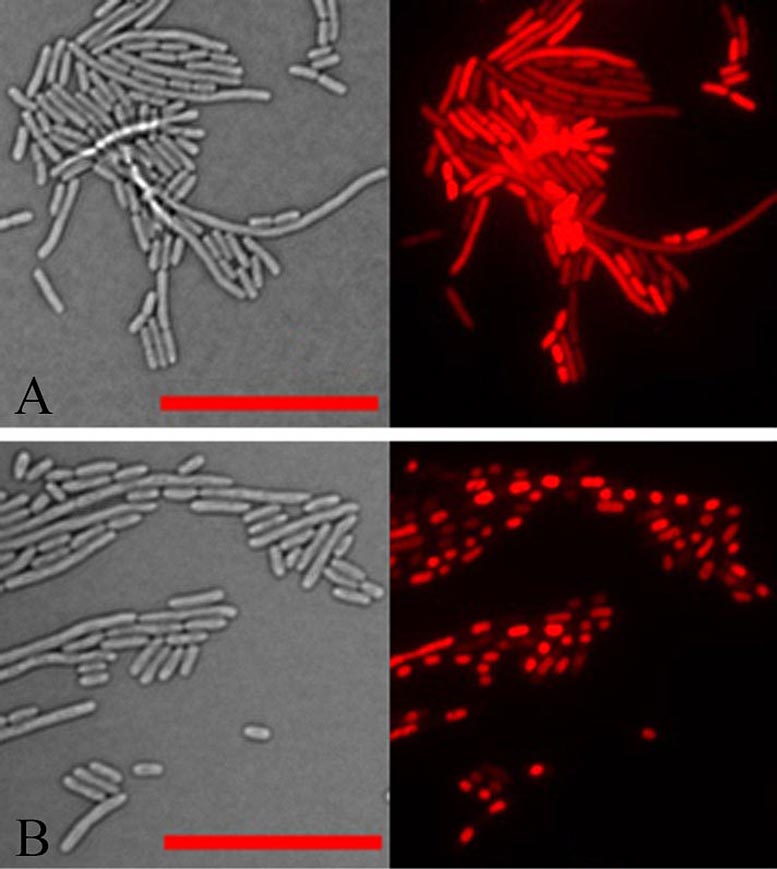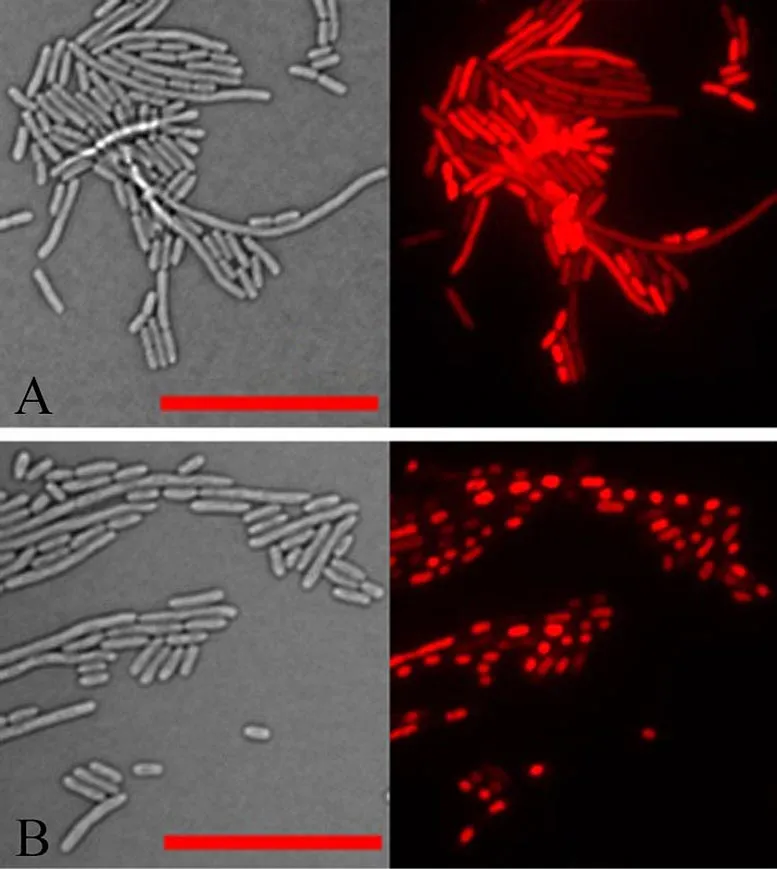
Images au microscope de cellules d’E. coli en lumière transmise (à gauche) et en lumière réfléchie qui capte la fluorescence rouge d’un colorant qui colore l’ADN des cellules (à droite). Dans les cellules normales (panneau supérieur), l’ADN est réparti dans toutes les cellules. Mais dans les cellules exprimant la protéine végétale aberrante identifiée dans cette étude (panneau inférieur), tout l’ADN de chaque cellule s’est condensé en une masse dense. La condensation de l’ADN se produit également après que les bactéries ont été traitées avec des antibiotiques aminoglycosides. Crédit : Brookhaven National Laboratory
La découverte d’une protéine aberrante qui tue les cellules bactériennes pourrait aider à élucider le mécanisme de certains antibiotiques et ouvrir la voie à de nouveaux médicaments.
Une protéine aberrante, mortelle pour les bactéries, a été découverte par des biologistes du Brookhaven National Laboratory du ministère américain de l’énergie et leurs collaborateurs. Dans un article qui sera publié aujourd’hui (29 avril 2022) dans la revue . PLOS ONEles scientifiques décrivent comment cette protéine construite de manière erronée imite l’action des aminoglycosides, une classe d’antibiotiques. La nouvelle protéine découverte pourrait servir de modèle aux scientifiques pour déchiffrer les spécificités de l’impact mortel de ces médicaments sur les bactéries – et peut-être ouvrir la voie à de futurs antibiotiques.
“L’identification de nouvelles cibles chez les bactéries et de stratégies alternatives pour contrôler la croissance bactérienne va devenir de plus en plus importante”, a déclaré le biologiste de Brookhaven Paul Freimuth, qui a dirigé les recherches. Les bactéries deviennent résistantes à plusieurs antibiotiques couramment utilisés, et de nombreux scientifiques et cliniciens sont préoccupés par la possibilité d’épidémies à grande échelle causées par ces bactéries résistantes aux antibiotiques, a-t-il expliqué.
“Ce que nous avons découvert est loin de devenir un médicament, mais la première étape est de comprendre le mécanisme”, a déclaré Freimuth. “Nous avons identifié une seule protéine qui imite l’effet d’un mélange complexe de protéines aberrantes fabriquées lorsque les bactéries sont traitées avec des aminoglycosides. Cela nous donne un moyen d’étudier le mécanisme qui tue les cellules bactériennes. Ensuite, on pourrait peut-être développer une nouvelle famille d’inhibiteurs pour faire la même chose.”
Suivant une branche intéressante
Les scientifiques de Brookhaven, qui se concentrent normalement sur la recherche liée à l’énergie, ne pensaient pas à la santé humaine lorsqu’ils ont commencé ce projet. Ils utilisaientE. coli bactéries pour étudier les gènes impliqués dans la construction des parois cellulaires des plantes. Cette recherche pourrait aider les scientifiques à apprendre comment convertir plus efficacement la matière végétale (biomasse) en biocarburants.

Paul Freimuth, biologiste au Brookhaven Lab, et Feiyue Teng, co-auteur, scientifique au Center for Functional Nanomaterials (CFN) du Brookhaven Lab, devant le microscope optique utilisé pour visualiser les bactéries dans cette étude. Crédit : Brookhaven National Laboratory
Mais lorsqu’ils ont activé l’expression d’un gène végétal particulier, permettant aux bactéries de fabriquer la protéine, les cellules ont immédiatement cessé de croître.
“Cette protéine a eu un effet toxique aigu sur les cellules. Toutes les cellules sont mortes dans les minutes qui ont suivi l’activation de l’expression de ce gène”, a déclaré Freimuth.
Comprendre la base de cette inhibition rapide de la croissance cellulaire était un projet de recherche idéal pour les stagiaires d’été travaillant dans le laboratoire de Freimuth.
“Les stagiaires pouvaient réaliser des expériences et voir les effets en une seule journée”, a-t-il déclaré. Et peut-être pourraient-ils aider à comprendre pourquoi une protéine végétale peut causer des dommages aussi importants.
Code mal lu, protéines dépliées
“C’est à ce moment-là que les choses ont commencé à devenir vraiment intéressantes”, a déclaré Freimuth.
Le groupe a découvert que le facteur toxique n’était pas du tout une protéine végétale. C’était un brin de
;” data-gt-translate-attributes=”[{” attribute=””>amino acids, the building blocks of proteins, that made no sense.
This nonsense strand had been churned out by mistake when the bacteria’s ribosomes (the cells’ protein-making machinery) translated the letters that make up the genetic code “out of phase.” Instead of reading the code in chunks of three letters that code for a particular amino acid, the ribosome read only the second two letters of one chunk plus the first letter of the next triplet. That resulted in putting the wrong amino acids in place.
“It would be like reading a sentence starting at the middle of each word and joining it to the first half of the next word to produce a string of gibberish,” Freimuth said.
The gibberish protein reminded Freimuth of a class of antibiotics called aminoglycosides. These antibiotics force ribosomes to make similar “phasing” mistakes and other sorts of errors when building proteins. The result: all the bacteria’s ribosomes make gibberish proteins.
“If a bacterial cell has 50,000 ribosomes, each one churning out a different aberrant protein, does the toxic effect result from one specific aberrant protein or from a combination of many? This question emerged decades ago and had never been resolved,” Freimuth said.
According to the current findings, just a single aberrant protein can be sufficient for the toxic effect.
That wouldn’t be too farfetched. Nonsense strands of amino acids can’t fold up properly to become fully functional. Although misfolded proteins get produced in all cells by chance errors, they usually are detected and eliminated completely by “quality control” machinery in healthy cells. Breakdown of quality control systems could make aberrant proteins accumulate, causing disease.
Messed-up quality control
The next step was to find out if the aberrant plant protein could activate the bacterial cells’ quality control system—or somehow block that system from working.
Freimuth and his team found that the aberrant plant protein indeed activated the initial step in protein quality control, but that later stages of the process directly required for degradation of aberrant proteins were blocked. They also discovered that the difference between cell life and death was dependent on the rate at which the aberrant protein was produced.
“When cells contained many copies of the gene coding for the aberrant plant protein, the quality control machinery detected the protein but was unable to fully degrade it,” Freimuth said. “When we reduced the number of gene copies, however, the quality control machinery was able to eliminate the toxic protein and the cells survived.”
The same thing happens, he noted, in cells treated with sublethal doses of aminoglycoside antibiotics. “The quality control response was strongly activated, but the cells still were able to continue to grow,” he said.
Model for mechanism
These experiments indicated that the single aberrant plant protein killed cells by the same mechanism as the complex mixture of aberrant proteins induced by aminoglycoside antibiotics. But the precise mechanism of cell death is still a mystery.
“The good news is that now we have a single protein, with a known amino acid sequence, that we can use as a model to explore that mechanism,” Freimuth said.
Scientists know that cells treated with the antibiotics become leaky, allowing toxic levels of things like salts to seep in. One hypothesis is that the misfolded proteins might form new channels in cellular membranes, or alternatively jam open the gates of existing channels, allowing diffusion of salts and other toxic substances across the cell membrane.
“A next step would be to determine structures of our protein in complex with membrane channels, to investigate how the protein might inhibit normal channel function,” Freimuth said.
That would help advance understanding of how the aberrant proteins induced by aminoglycoside antibiotics kill bacterial cells—and could inform the design of new drugs to trigger the same or similar effects.
Reference: “A polypeptide model for toxic aberrant proteins induced by aminoglycoside antibiotics” 29 April 2022, PLOS ONE.
DOI: 10.1371/journal.pone.0258794
This work was supported by a Laboratory Directed Research and Development award from Brookhaven Lab and in part by the DOE Office of Science, Office of Workforce Development for Teachers and Scientists (WDTS) under the Visiting Faculty Program (VFP). Additional funding from the National Science Foundation (NSF) supported students participating in internships under NSF’s Science, Technology, Engineering, and Mathematics Talent Expansion Program (STEP) and the Louis Stokes Alliances for Minority Participation (LSAMP) program.