Une équipe de recherche révèle les mécanismes des rythmes circadiens chez les cyanobactéries.
Les scientifiques veulent améliorer leur compréhension des rythmes circadiens, ces cycles internes de 24 heures de sommeil et d’éveil qui se produisent dans les organismes, allant des humains aux plantes, en passant par les champignons et les bactéries. Une équipe de chercheurs a examiné les rouages complexes de la cyanobactérie et peut désormais mieux comprendre ce qui commande son horloge circadienne.
L’équipe, dirigée par des chercheurs de l’Institut des sciences moléculaires de l’Institut national des sciences naturelles d’Okazaki, au Japon, a publié ses conclusions le 15 avril 2022 dans la revue Science Advances.
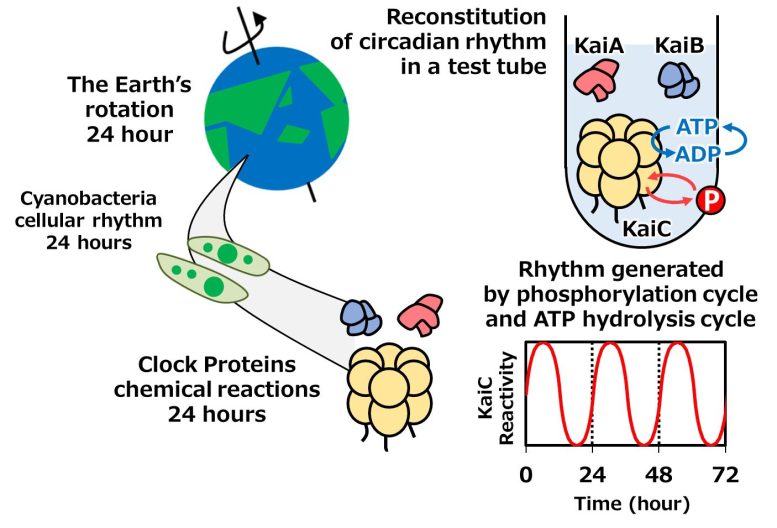
Figure 1. Protéines d’horloge générant les rythmes circadiens des cyanobactéries. Les rythmes circadiens du cycle de phosphorylation (cercle rouge avec “P” indiquant le transfert de phosphore) et du cycle d’hydrolyse de l’ATP (cercle bleu avec “ATP” et “ADP” indiquant la conversion de l’Adénosine-TriPhosphate en Adénosine-DiPhosphate) peuvent être observés dans un tube à essai. Crédit : NINS/IMS
L’équipe a concentré ses recherches sur KaiC, la protéine d’horloge qui régule le rythme circadien chez les cyanobactéries, un type de bactérie vivant dans tous les types d’eau et que l’on retrouve souvent dans les algues bleues (Figure 1, panneau de gauche). Les horloges biologiques des organismes sont composées de protéines (figure 1, panneau supérieur droit). L’horloge circadienne cyanobactérienne est l’horloge circadienne la plus simple en ce qui concerne le nombre de ses composants, mais il s’agit néanmoins d’un système très complexe qui peut fournir aux scientifiques des indices sur le fonctionnement de toutes les horloges circadiennes. Les cyanobactéries bleuâtres sont des micro-organismes que l’on trouve dans des environnements allant des eaux salées et douces aux sols et aux roches. L’équipe a examiné la base structurelle de l’allostérie, les changements complexes qui se produisent dans la forme et l’activité de la protéine KaiC dans les cyanobactéries (figure 1, panneau inférieur droit). L’allostérie commande l’horloge circadienne des cyanobactéries.
L’équipe a étudié les structures atomiques de la protéine de l’horloge KaiC, en passant en revue des milliers de conditions de cristallisation. Cette étude détaillée des structures atomiques leur a permis de couvrir l’ensemble du cycle de phosphorylation, ce processus où un phosphate est transféré à la protéine (Figure 2, panneau inférieur). La phosphorylation coopère avec un autre cycle de réaction, l’hydrolyse de l’ATP, qui est l’événement consommateur d’énergie déterminant la vitesse de l’horloge (figure 2, panneau supérieur). Le système phosphorylation-hydrolyse ATP fonctionne comme un régulateur de l’activité cellulaire. Pour les aider à comprendre la base de l’allostérie, ils ont cristallisé la protéine KaiC dans huit états distincts, ce qui leur a permis d’observer la coopérativité entre le cycle de phosphorylation et le cycle d’hydrolyse de l’ATP fonctionnant comme deux engrenages (figure 2).
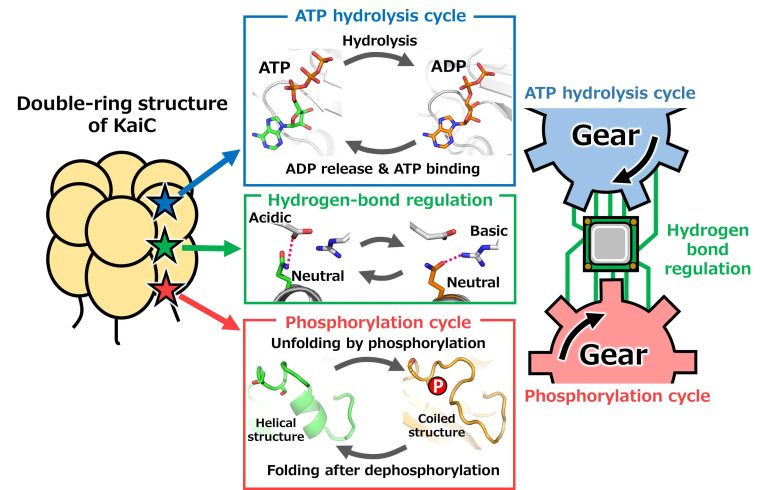
Figure 2. Mouvement coopératif de deux engrenages tournant dans KaiC. Le cycle de phosphorylation et le cycle d’hydrolyse de l’ATP se déroulent dans la structure à double anneau de KaiC. Les deux cycles sont médiés par des liaisons hydrogène entre les composants acides, basiques et neutres. NINS/IMS
Dans le passé, les scientifiques ont étudié le cycle du phosphore de la protéine KaiC. in vivio, in vitroet in silico. Pourtant, on savait peu de choses sur la façon dont l’allostérie régule le cycle du phosphore dans KaiC.
En étudiant la KaiC dans les huit états distincts, l’équipe a pu observer un couplage qui se produit dans le cycle du phosphore et le cycle d’hydrolyse de l’ATPase. Ce couplage des deux engrenages entraîne l’horloge circadienne des cyanobactéries.
“Comme les protéines sont composées d’un très grand nombre d’atomes, il n’est pas facile de comprendre les mécanismes de leurs fonctions compliquées mais ordonnées. Nous devons suivre patiemment les changements structurels des protéines”, a déclaré Yoshihiko Furuike, professeur adjoint à l’Institut des sciences moléculaires, Instituts nationaux des sciences naturelles.
La protéine KaiC active et désactive rythmiquement les cycles de réaction de manière autonome pour réguler les états d’assemblage d’autres protéines liées à l’horloge. En pensant à leurs prochaines étapes, l’équipe pourrait donc utiliser la biologie structurale pour révéler les mécanismes atomiques d’accélération et de décélération des rotations de l’engrenage. “Notre objectif est de voir toutes les protéines d’horloge des cyanobactéries pendant l’oscillation à un niveau atomique et de décrire le moment où le rythme ordonné découle d’une dynamique atomique chaotique”, a déclaré Furuike.
Leur travail peut servir d’outil de recherche, aidant les scientifiques à mieux comprendre le fonctionnement de l’horloge.comprendre les mécanismes à l’œuvre dans le cycle de l’horloge circadienne. Pour l’avenir, l’équipe de recherche estime que ses résultats auront des applications plus larges. Les mammifères, les insectes, les plantes et les bactéries possèdent tous leurs propres protéines d’horloge avec des séquences et des structures distinctes. “Toutefois, la logique qui sous-tend la relation entre la dynamique du KaiC et les fonctions de l’horloge peut être appliquée à d’autres études sur divers organismes”, a déclaré Furuike.
Référence : “Elucidation de l’allostérie maîtresse essentielle à l’oscillation de l’horloge circadienne chez les cyanobactéries” 15 avril 2022, Science Advances.
DOI : 10.1126/sciadv.abm8990
Les auteurs de l’article sont Yoshihiko Furuike, Shuji Akiyama, Institut des sciences moléculaires, Instituts nationaux des sciences naturelles, Okazaki, Japon.
Outre les chercheurs de l’Institut des sciences moléculaires, d’autres membres de l’équipe sont des chercheurs de SOKENDAI, de l’Université des hautes études, de l’École supérieure des sciences et de l’Institut des hautes études de l’Université de Nagoya et de l’Institut de recherche sur les protéines de l’Université d’Osaka. Leurs travaux ont été financés par des subventions d’aide à la recherche scientifique.