Les biochimistes étudient lorsque les enzymes de nos cellules se dérèglent et se comportent mal dans les maladies humaines.
Un chercheur de l’Université du Delaware a reçu une subvention du NIH pour étudier pourquoi les enzymes de la gomme vont mal et conduisent au cancer.
Le biochimiste de l’Université du Delaware, Jeff Mugridge, essaie de comprendre comment les enzymes de gomme à ARNm fonctionnent dans nos cellules, pourquoi ces gommes peuvent parfois mal se comporter et conduire au cancer, et comment la science peut ouvrir la voie à des solutions possibles à ce problème.
ribonucléique acide (ARN) est une molécule simple brin qui est copiée à partir du ADN dans nos corps. Les molécules d’ARN messager (ARNm) portent le code d’instructions qui indique à nos cellules comment faire tout ce dont elles ont besoin pour survivre, comme quand, où et comment fabriquer des protéines ou des enzymes.
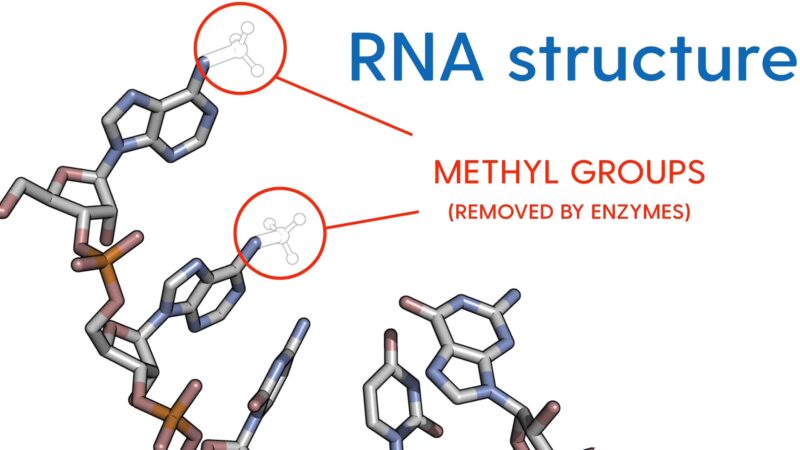
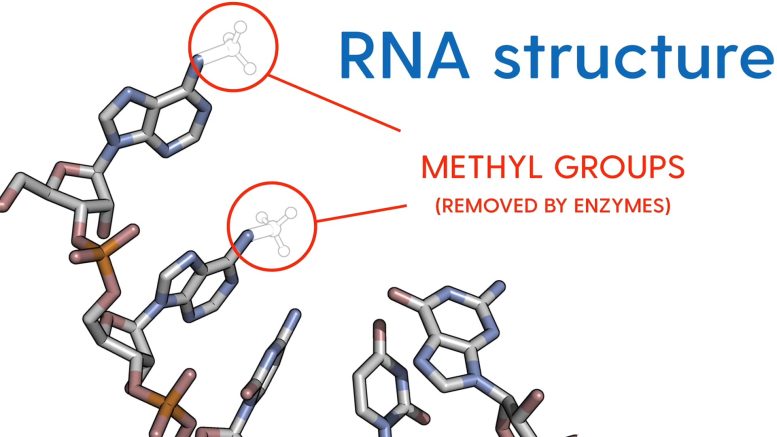
L’une des nombreuses façons dont les cellules de notre corps contrôlent les molécules d’ARNm est de les décorer avec différents groupes chimiques qui modifient subtilement ou radicalement la façon dont les messages sont transmis.
Mugridge, professeur adjoint de chimie et de biochimie, a récemment reçu 1 956 466 $ des National Institutes of Health (NIH) pour étudier des enzymes spécifiques qui peuvent agir comme des gommes et éliminer les groupes chimiques critiques, appelés groupes méthyle, trouvés sur les molécules d’ARNm.
Dans le cas de cancers difficiles à traiter comme le glioblastome, ces enzymes de gomme méthylique sont parfois surexprimées dans les cellules cancéreuses, ce qui signifie que trop d’enzymes de gomme fonctionnent à la fois. Cela peut faire en sorte que les molécules d’ARNm manquent d’informations importantes, ce qui peut modifier les messages qu’elles délivrent d’une manière qui conduit à la progression du cancer et à la croissance tumorale.

Le professeur adjoint de l’Université du Delaware, Jeff Mugridge, étudie les enzymes de gomme qui peuvent éliminer des groupes chimiques importants de l’ARNm, les molécules de notre corps qui portent des instructions et un code pour indiquer à nos cellules comment fonctionner. Le travail a le potentiel d’éclairer les options de traitement pour diverses maladies humaines où ces enzymes de gomme se comportent mal. Crédit : Photo par Evan Krape
On sait peu de choses sur la façon dont ces enzymes de gomme décident quels groupes méthyle éliminer ou conserver, à quelle fréquence elles effacent les groupes méthyle dans les cellules saines ou pourquoi elles se comportent mal dans certaines maladies humaines.
Taquiner les détails fondamentaux
Avec deux doctorants travaillant dans son laboratoire, Mugridge étudie spécifiquement une classe d’enzymes gommes appelées ARN déméthylases. Les déméthylases éliminent les groupes méthyle sur l’ARN qui jouent un rôle important dans l’expression des gènes et la progression de cancers comme le glioblastome ou la leucémie myéloïde aiguë.
La méthylation de l’ARN est un processus biochimique qui peut agir comme un interrupteur et activer ou désactiver certaines activités dans nos cellules. Il est connu pour être important pour produire des molécules d’ARN correctement formées, synthétiser des protéines et déterminer la durée de vie des molécules d’ARN dans la cellule, entre autres. Les modifications méthyliques de l’ARNm jouent également un rôle dans les décisions concernant le destin des cellules et la façon dont les cellules souches embryonnaires sont différenciées au cours du développement.
Les scientifiques ont récemment identifié quelques gommes de modification d’ARN méthyle, ce qui a soulevé la possibilité intrigante que ces groupes méthyle puissent être à la fois écrits et effacés d’un transcrit d’ARNm, a déclaré Mugridge. Mais comment ces enzymes de gomme reconnaissent et choisissent quels groupes méthyle spécifiques à éliminer parmi les milliers que l’on trouve sur l’ARN, et à quelle fréquence elles le font, reste mal comprise.
Cela arrive-t-il tout le temps ou est-ce un événement rare? Cela ne se produit-il que dans la maladie ou dans des types cellulaires spécifiques ? Telles sont quelques-unes des questions auxquelles Mugridge et son équipe prévoient de répondre. L’équipe de recherche explorera également comment les protéines et d’autres cofacteurs, tels que la vitamine C, régulent l’activité de la déméthylase dans la cellule.
« À long terme, si nous avons une image haute résolution du fonctionnement de ces enzymes déméthylases, nous pouvons alors commencer à comprendre comment chaque gomme est liée à différentes maladies humaines et à la progression de la maladie », a déclaré Mugridge. “Cela nous donnera de meilleures informations sur lesquelles de ces enzymes cibler pour l’inhibition et comment, par exemple, ralentir la progression tumorale dans le cancer.”
Par exemple, dans le glioblastome, une enzyme gomme connue sous le nom de FTO est surexprimée, ce qui signifie que les cellules du glioblastome en produisent beaucoup plus que les cellules normales. Cela conduit à beaucoup d’activité d’effacement de méthyle sur l’ARN dans ces cellules cancéreuses, ce qui semble être important pour la progression du cancer. La recherche a montré que lorsque FTO est inhibé par un médicament, il ralentit la progression du cancer dans le glioblastome. Cependant, les thérapies qui peuvent cibler sélectivement et efficacement les enzymes ARN déméthylase pour traiter les cancers ont échappé aux scientifiques.
Si Mugridge et son équipe peuvent comprendre les détails moléculaires du fonctionnement de ces enzymes déméthylases et de la façon dont la cellule contrôle leurs fonctions, ils pourraient chercher des moyens de manipuler quels groupes méthyle sont effacés de l’ARN et ouvrir la voie à des thérapies qui aident à corriger le mauvais comportement de la gomme. enzymes dans la maladie.
« Si nous comprenions comment la molécule d’ARN se lie, exactement où elle se lie à la surface de la protéine et comment elle interagit avec des acides aminés qui composent la protéine, nous pourrions peut-être combler les pièces manquantes du puzzle, puis développer des outils pour surveiller ou influencer cette activité d’effacement dans les cellules », a-t-il déclaré.
À la recherche d’indices dans les moindres détails
Au laboratoire Brown, Mugridge et ses étudiants produisent des protéines dans des cellules bactériennes, puis purifient et isolent les ARN déméthylases d’intérêt. Brittany Shimanski, doctorante du programme Interface Chimie-Biologie, utilise ces enzymes purifiées pour mener des études de biochimie et de biologie structurale afin de mieux comprendre le fonctionnement des enzymes gomme et sélectionner leurs cibles.
Mugridge a expliqué que si l’équipe peut cultiver des cristaux de protéines en complexe avec les groupes d’ARN modifiés sur lesquels ils agissent, ils peuvent les emmener dans un laboratoire national et les filmer avec des rayons X à haute intensité pour obtenir des images 3D de la forme de l’enzyme. , y compris des informations sur l’emplacement de tous les atomes et sur la manière dont les enzymes se lient à l’ARN méthylé qu’elles vont effacer.
Ces informations de biologie structurelle à l’échelle atomique peuvent fournir des informations essentielles sur le fonctionnement d’une enzyme et informeront également le travail du doctorant Luke Calzini pour comprendre comment ces enzymes gommes sont contrôlées par différentes protéines ou cofacteurs à petites molécules, tels que la vitamine C, qui peuvent changer leur activité ou leur sélectivité.
Les travaux pourraient également donner aux scientifiques de nouvelles façons de poser des questions spécifiques dans les cellules.
“Nous avons l’impression de travailler sur un problème important qui pourrait être important pour comprendre comment fonctionnent différentes maladies et comment elles sont affectées par les changements dans la méthylation de l’ARN”, a déclaré Mugridge.
Le nouveau projet de cinq ans est financé par le programme Maximizing Investigators’ Research Award (MIRA) du NIH.