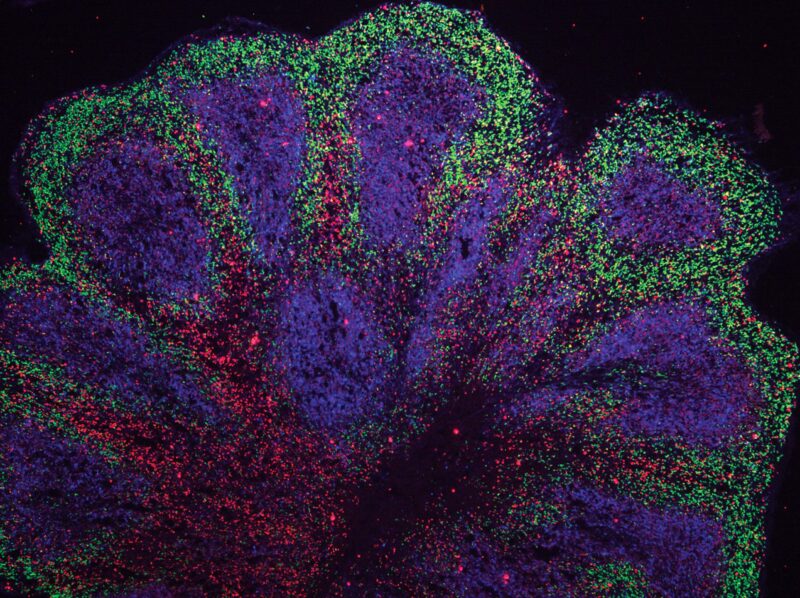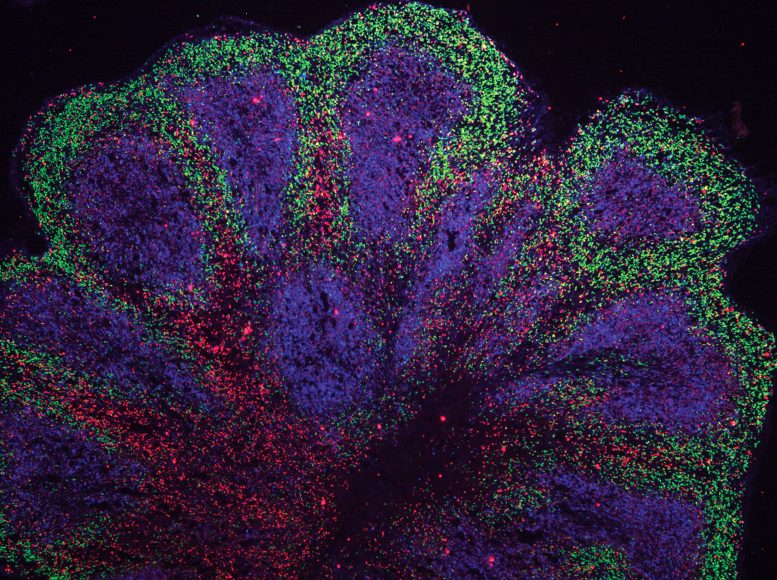
Organoïdes du mini-cerveau présentant des structures de type cortex. Crédit : Andras Lakatos/Université de Cambridge
Des chercheurs de Cambridge ont développé des « mini cerveaux » qui leur permettent d’étudier un trouble neurologique mortel et incurable provoquant la paralysie et la démence – et pour la première fois, ils ont pu les développer pendant près d’un an.
Une forme courante de maladie des motoneurones, la sclérose latérale amyotrophique, chevauche souvent la démence frontotemporale (SLA/FTD) et peut affecter les personnes plus jeunes survenant principalement après l’âge de 40-45 ans. Ces conditions provoquent des symptômes dévastateurs de faiblesse musculaire avec des changements dans la mémoire, le comportement et la personnalité. Être capable de développer de petits modèles de cerveau ressemblant à des organes (organoïdes) permet aux chercheurs de comprendre ce qui se passe aux premiers stades de la SLA/FTD, bien avant que les symptômes ne commencent à apparaître, et de rechercher des médicaments potentiels.
En général, les organoïdes, souvent appelés « mini-organes », sont de plus en plus utilisés pour modéliser la biologie et les maladies humaines. Rien qu’à l’Université de Cambridge, les chercheurs les utilisent pour réparer les foies endommagés, étudier Infection des poumons par le SRAS-CoV-2, et modéliser le premiers stades de la grossesse, parmi de nombreux autres domaines de recherche.
En règle générale, les chercheurs prélèvent des cellules de la peau d’un patient et reprogramment les cellules à leur stade de cellules souches – un stade très précoce de développement auquel elles ont le potentiel de se développer en la plupart des types de cellules. Ceux-ci peuvent ensuite être cultivés en grappes 3D qui imitent des éléments particuliers d’un organe. Comme de nombreuses maladies sont causées en partie par des défauts de notre ADN, cette technique permet aux chercheurs de voir comment les changements cellulaires – souvent associés à ces mutations génétiques – conduisent à la maladie.
Des scientifiques du John van Geest Center for Brain Repair, Université de Cambridge, ont utilisé des cellules souches dérivées de patients souffrant de SLA/FTD pour cultiver des organoïdes cérébraux. Ceux-ci ressemblent à des parties du cortex cérébral humain en termes de jalons de développement embryonnaire et fœtal, d’architecture 3D, de diversité de type cellulaire et d’interactions cellule-cellule.
Bien que ce ne soit pas la première fois que des scientifiques développent des mini-cerveaux de patients atteints de maladies neurodégénératives, la plupart des efforts n’ont pu les développer que pendant une période de temps relativement courte, représentant un spectre limité de troubles liés à la démence. Dans des conclusions publiées le 21 octobre 2021 dans Neurosciences de la nature, l’équipe de Cambridge rapporte avoir cultivé ces modèles pendant 240 jours à partir de cellules souches abritant la mutation génétique la plus courante dans la SLA/FTD, ce qui n’était pas possible auparavant – et dans des travaux non publiés, l’équipe les a cultivés pendant 340 jours.
Le Dr András Lakatos, auteur principal qui a dirigé la recherche au Département de neurosciences cliniques de Cambridge, a déclaré : « Les maladies neurodégénératives sont des troubles très complexes qui peuvent affecter de nombreux types de cellules différents et la façon dont ces cellules interagissent à différents moments à mesure que les maladies progressent.
«Pour nous rapprocher de cette complexité, nous avons besoin de modèles qui durent plus longtemps et reproduisent la composition des populations de cellules cérébrales humaines dans lesquelles des perturbations se produisent généralement, et c’est ce que propose notre approche. Non seulement pouvons-nous voir ce qui peut se produire au début de la maladie – bien avant qu’un patient ne ressente des symptômes – mais nous pouvons également commencer à voir comment les perturbations changent au fil du temps dans chaque cellule. »
Alors que les organoïdes sont généralement cultivés sous forme de boules de cellules, le premier auteur, le Dr Kornélia Szebényi, a généré des cultures de tranches d’organoïdes dérivées de cellules de patients dans le laboratoire du Dr Lakatos. Cette technique a permis à la plupart des cellules du modèle de recevoir les nutriments nécessaires pour les maintenir en vie.
Le Dr Szebényi a déclaré : « Lorsque les cellules sont regroupées dans des sphères plus grandes, les cellules du noyau peuvent ne pas recevoir une nutrition suffisante, ce qui peut expliquer pourquoi les tentatives précédentes de faire pousser des organoïdes à long terme à partir des cellules des patients ont été difficiles ».
En utilisant cette approche, le Dr Szebényi et ses collègues ont observé des changements se produisant dans les cellules des organoïdes à un stade très précoce, notamment un stress cellulaire, des dommages à l’ADN et des changements dans la façon dont l’ADN est transcrit en protéines. Ces changements ont affecté les cellules nerveuses et autres cellules cérébrales appelées astroglie, qui orchestrent les mouvements musculaires et les capacités mentales.
“Bien que ces perturbations initiales aient été subtiles, nous avons été surpris de voir à quel point les premiers changements se sont produits dans notre modèle humain de SLA/FTD”, a ajouté le Dr Lakatos. « Cette étude et d’autres études récentes suggèrent que les dommages peuvent commencer à s’accumuler dès notre naissance. Nous aurons besoin de plus de recherches pour comprendre si c’est effectivement le cas, ou si ce processus est avancé dans les organoïdes par les conditions artificielles dans le plat.
En plus d’être utiles pour comprendre le développement de la maladie, les organoïdes peuvent être un outil puissant pour le dépistage de médicaments potentiels afin de déterminer ceux qui peuvent prévenir ou ralentir la progression de la maladie. Il s’agit d’un avantage crucial des organoïdes, car les modèles animaux ne montrent souvent pas les changements typiques liés à la maladie et il serait impossible d’échantillonner le cerveau humain pour cette recherche.
L’équipe a montré qu’un médicament, le GSK2606414, était efficace pour soulager les problèmes cellulaires courants dans la SLA/FTD, notamment l’accumulation de protéines toxiques, le stress cellulaire et la perte de cellules nerveuses, bloquant ainsi l’une des voies qui contribuent à la maladie. Des médicaments similaires qui sont plus appropriés comme médicaments et approuvés pour un usage humain sont maintenant testés dans des essais cliniques pour les maladies neurodégénératives.
Le Dr Gabriel Balmus du UK Dementia Research Institute de l’Université de Cambridge, auteur principal collaborateur, a déclaré : « En modélisant certains des mécanismes qui conduisent à des dommages à l’ADN dans les cellules nerveuses et en montrant comment ceux-ci peuvent conduire à divers également être en mesure d’identifier d’autres cibles médicamenteuses potentielles.
Le Dr Lakatos a ajouté : « Nous n’avons actuellement aucune option très efficace pour traiter la SLA/FTD, et bien qu’il y ait beaucoup plus de travail à faire après notre découverte, cela offre au moins l’espoir qu’il sera peut-être possible à terme de prévenir ou de ralentir. le processus de la maladie.
“Il sera peut-être également possible à l’avenir de pouvoir prélever des cellules de peau d’un patient, de les reprogrammer pour développer leur” mini cerveau “et de tester quelle combinaison unique de médicaments convient le mieux à leur maladie.”
Référence : « Les cultures de tranches d’organoïdes de cerveau humain ALS/FTD présentent une pathologie neuronale distincte et cible d’astrocytes précoces » par Kornélia Szebényi, Léa MD Wenger, Yu Sun, Alexander WE Dunn, Colleen A. Limegrover, George M. Gibbons, Elena Conci, Ole Paulsen , Susanna B. Mierau, Gabriel Balmus et András Lakatos, 21 octobre 2021, Neurosciences de la nature.
DOI : 10.1038 / s41593-021-00923-4
L’étude a été principalement financée par le Medical Research Council UK, Wellcome Trust et Evelyn Trust.