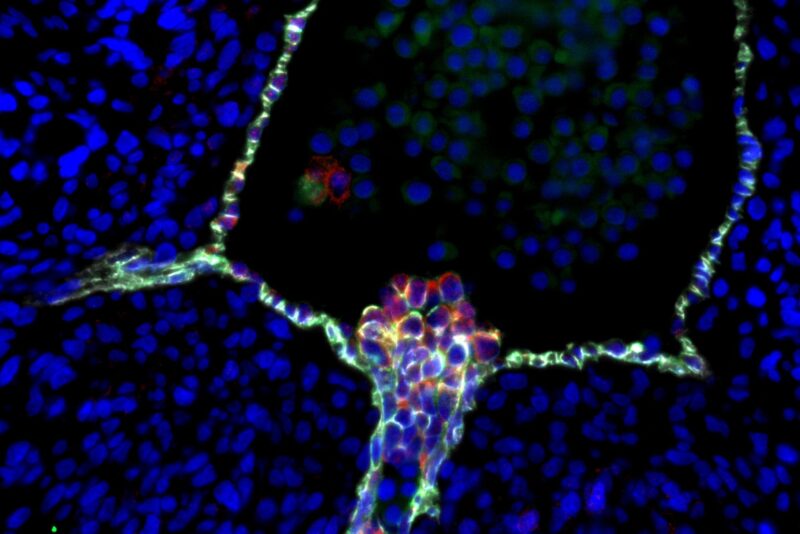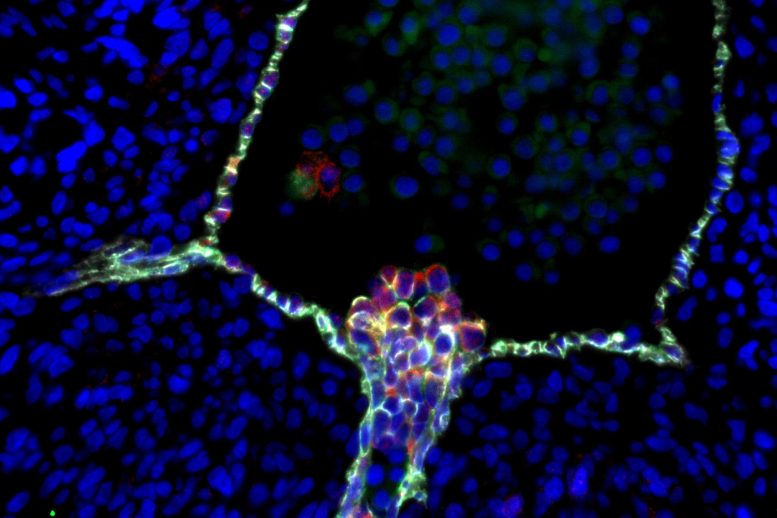
Des cellules souches du sang humain émergent de cellules endothéliales spécialisées dans la paroi d’une aorte embryonnaire. La confirmation de ce processus par les scientifiques de l’UCLA clarifie une controverse de longue date sur l’origine cellulaire des cellules souches. Crédit : Hanna Mikkola Lab/UCLA, Katja Schenke-Layland Lab/Université de Tübingen, Nature
Des scientifiques de l’UCLA et leurs collègues ont créé une feuille de route, la première du genre, qui retrace chaque étape du développement des cellules souches du sang dans l’embryon humain, fournissant ainsi aux scientifiques un plan pour produire des cellules souches du sang entièrement fonctionnelles en laboratoire.
La recherche, publiée aujourd’hui (13 avril 2022) dans le journal NatureHanna Mikkola, du Eli and Edythe Broad Center of Regenerative Medicine and Stem Cell Research de l’UCLA, qui a dirigé l’étude, a déclaré que cette recherche pourrait contribuer à élargir les options de traitement des cancers du sang, comme la leucémie, et des troubles sanguins héréditaires, comme la drépanocytose.
Les cellules souches du sang, également appelées cellules souches hématopoïétiques, ont la capacité de se reproduire en nombre illimité et de se différencier en chaque type de cellule sanguine du corps humain. Depuis des décennies, les médecins utilisent des cellules souches sanguines provenant de la moelle osseuse de donneurs et du cordon ombilical de nouveau-nés dans des traitements de transplantation vitaux pour les maladies sanguines et immunitaires. Toutefois, ces traitements sont limités par la pénurie de donneurs compatibles et entravés par le faible nombre de cellules souches dans le sang du cordon.
Les chercheurs ont tenté de surmonter ces limites en essayant de créer des cellules souches sanguines en laboratoire à partir de cellules souches pluripotentes humaines, qui peuvent potentiellement donner naissance à n’importe quel type de cellule dans le corps. Mais le succès n’a pas été au rendez-vous, en partie parce que les scientifiques n’avaient pas les instructions nécessaires pour que les cellules cultivées en laboratoire se différencient en cellules souches sanguines auto-renouvelables plutôt qu’en cellules progénitrices sanguines de courte durée, qui ne peuvent produire que des types limités de cellules sanguines.

Vincenzo Calvanese (à gauche) et Hanna Mikkola travaillent ensemble à l’UCLA sur la recherche sur les cellules souches du sang depuis 2012. Crédit : Eddy Marcos Panos (à gauche) ; Reed Hutchinson/UCLA
“Personne n’a réussi à fabriquer des cellules souches sanguines fonctionnelles à partir de cellules souches pluripotentes humaines parce que nous n’en savions pas assez sur la cellule que nous essayions de générer”, a déclaré Hanna Mikkola, qui est professeur de biologie moléculaire, cellulaire et du développement au Collège de l’UCLA et membre du UCLA Jonsson Comprehensive Cancer Center.
La nouvelle feuille de route aidera les chercheurs à comprendre les différences fondamentales entre les deux types de cellules, ce qui est essentiel pour créer des cellules qui peuvent être utilisées dans les thérapies de transplantation, a déclaré le scientifique Vincenzo Calvanese de l’UCLA, co-auteur principal de la recherche, avec Sandra Capellera-Garcia et Feiyang Ma de l’UCLA.
“Nous disposons maintenant d’un manuel sur la façon dont les cellules souches hématopoïétiques sont fabriquées dans l’embryon et comment elles acquièrent les propriétés uniques qui les rendent utiles aux patients”, a déclaré M. Calvanese, qui est également chef de groupe à l’University College de Londres. Les données dépersonnalisées sont à la disposition du public sur le site Web suivant L’Atlas du développement des cellules souches hématopoïétiques humaines.
L’équipe de recherche, qui comprenait des scientifiques de l’université de Tübingen en Allemagne et du Murdoch Children’s Research Institute en Australie, a créé cette ressource en utilisant des cellules uniques RNA sequencing and spatial transcriptomics, new technologies that enable scientists to identify the unique genetic networks and functions of thousands of individual cells and to reveal the location of these cells in the embryo.
The data make it possible to follow blood stem cells as they emerge from the hemogenic endothelium and migrate through various locations during their development, starting from the aorta and ultimately arriving in the bone marrow. Importantly, the map unveils specific milestones in their maturation process, including their arrival in the liver, where they acquire the special abilities of blood stem cells.
To explain the maturation process, Mikkola compares immature blood stem cells to aspiring surgeons. Just as surgeons need to go through different stages of training to learn how to perform surgeries, immature blood stem cells must move through different locations to learn how to do their job as blood stem cells.
The research group also pinpointed the exact precursor in the blood vessel wall that gives rise to blood stem cells. This discovery clarifies a longstanding controversy about the stem cells’ cellular origin and the environment that is needed to make a blood stem cell rather than a blood progenitor cell.
Now that the researchers have identified specific molecular signatures associated with the different phases of human blood stem cell development, scientists can use this resource to see how close they are to making a transplantable blood stem cell in the lab.
“Previously, if we tried to create a blood stem cell from a pluripotent cell and it didn’t transplant, we wouldn’t know where in the process we failed,” Mikkola said. “Now, we can place the cells in our roadmap to see where we’re succeeding, where we’re falling short and fine-tune the differentiation process according to the instructions from the embryo.”
In addition, the map can help scientists understand how blood-forming cells that develop in the embryo contribute to human disease. For example, it provides the foundation for studying why some blood cancers that begin in utero are more aggressive than those that occur after birth.
“Now that we’ve created an online resource that scientists around the world can use to guide their research, the real work is starting,” Mikkola said. “It’s a really exciting time to be in the field because we’re finally going to be seeing the fruits of our labor.”
Reference: “Mapping human haematopoietic stem cells from haemogenic endothelium to birth” 13 April 2022, Nature.
DOI: 10.1038/s41586-022-04571-x
The research was supported by the National Institutes of Health, the UCLA Jonsson Cancer Center Foundation, the David Geffen School of Medicine at UCLA, the Swedish Research Council, the European Molecular Biology Organization, the Swiss National Science Foundation and the UCLA Broad Stem Cell Research Center (including support from the Rose Hills Foundation and the center’s training program).