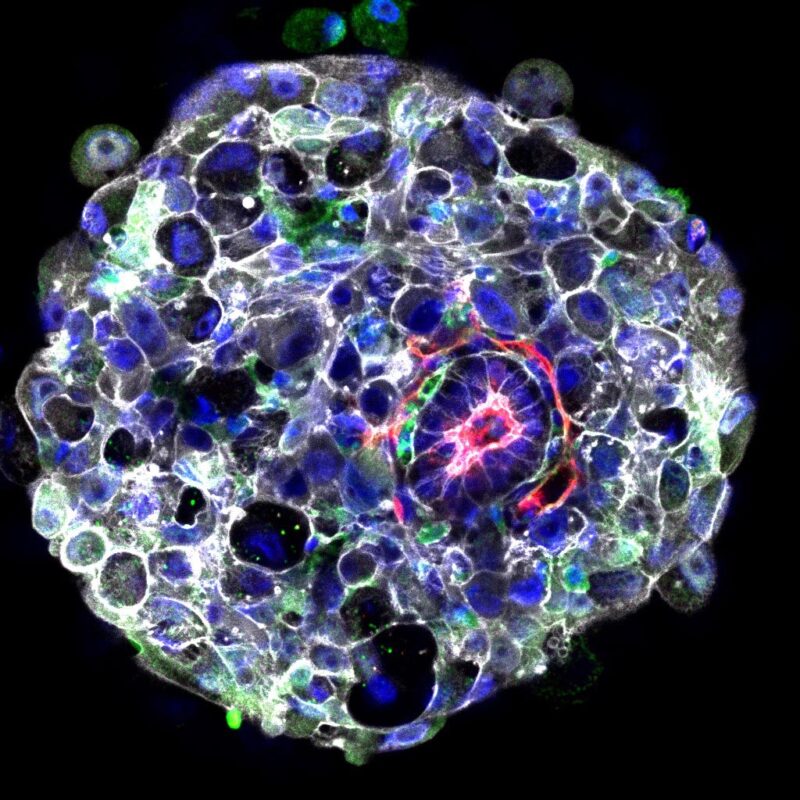
Un embryon humain en laboratoire 9 jours après la fécondation. L’hypoblaste (un groupe de cellules en dehors de l’embryon principal) envoie un message à l’embryon qui initie le développement de l’axe du corps tête-à-queue. En utilisant l’analyse par immunofluorescence, l’hypoblaste est représenté en vert – ces cellules sont distribuées de manière asymétrique. Une cavité est visible au centre de l’embryon marquée par une sécrétion de podocalyxine (rouge) et une accumulation de F-actine (blanc). Les noyaux sont colorés en bleu.
La deuxième semaine de gestation représente une étape critique du développement de l’embryon, ou embryogenèse. L’échec du développement pendant cette période est l’une des principales causes de perte de grossesse précoce.
En utilisant des embryons humains excédentaires donnés volontairement par des cliniques de fécondation in vitro au Royaume-Uni, les scientifiques ont étudié de manière approfondie la période de pré-implantation en laboratoire, la période avant qu’un embryon en développement ne s’implante dans l’utérus de la mère le septième jour après la fécondation. Cependant, on sait très peu de choses sur le développement de l’embryon humain après l’implantation, car l’embryon devient inaccessible pour l’étude.
En 2016, Magdalena Zernicka-Goetz, aujourd’hui professeure Bren de biologie et de génie biologique à Caltech, et son équipe de l’Université de Cambridge ont développé une technique pour cultiver des embryons humains en dehors du corps de la mère au-delà de l’implantation. Cela a permis d’étudier pour la première fois des embryons humains jusqu’au jour 14 de développement.
Dans une nouvelle étude, des chercheurs du laboratoire Zernicka-Goetz ont examiné ce qui se passe au niveau moléculaire au cours de cette première étape de l’embryogenèse. Leurs découvertes fournissent la première preuve qu’un groupe de cellules en forme de disque situé à l’extérieur de l’embryon connu sous le nom d’hypoblaste envoie un message à l’embryon qui initie la formation de l’axe du corps tête-à-queue, ce qui donne à l’embryon auparavant symétrique deux extrémités distinctes, une tête et une « queue ». Les résultats révèlent que les signaux moléculaires impliqués dans la formation de l’axe corporel chez les embryons humains sont similaires à ceux d’autres mammifères, malgré des différences significatives dans le positionnement et l’organisation des cellules des embryons de différentes espèces.
Les résultats sont décrits dans un article paru dans la revue Communication Nature.
“Nous avons révélé les schémas d’expression des gènes dans l’embryon en développement juste après son implantation dans l’utérus, ce qui reflète les multiples conversations en cours entre différents types de cellules au fur et à mesure que l’embryon se développe à travers ces premiers stades”, explique Zernicka-Goetz. «Nous recherchions les conversations génétiques qui permettront à la tête de commencer à se développer dans l’embryon et avons découvert qu’elles étaient initiées par les cellules de l’hypoblaste, qui ne contribueraient normalement pas à la construction du corps lui-même. Ils envoient le message aux cellules embryonnaires adjacentes, qui répondent en disant « OK, maintenant nous allons nous mettre de côté pour devenir la tête de réseau. »
L’étude a identifié ces conversations de gènes dans l’embryon en développement en séquençant le code dans les milliers de messagers ARN (ARNm) molécules fabriquées par des cellules individuelles ; Les molécules d’ARNm sont traduites par la machinerie cellulaire en molécules protéiques qui remplissent des fonctions vitales et donnent aux cellules leur structure. Cela a permis aux chercheurs de capturer les changements dans le profil moléculaire évolutif des embryons en développement après leur implantation dans l’utérus et a révélé la perte progressive de pluripotence des cellules embryonnaires (la capacité de donner naissance à n’importe quel type de cellule) à mesure qu’elles se transformaient en une cellule distincte. types qui finissent par donner naissance à tous les organes du corps humain.
« Notre objectif a toujours été de permettre un aperçu du développement très précoce de l’embryon humain dans un plat pour comprendre comment nos vies commencent. En combinant notre nouvelle technologie de culture d’embryons humains avec des méthodes de séquençage avancées, nous avons approfondi les principaux changements qui se produisent à ce stade incroyable du développement humain lorsque l’embryon se remodèle pour prendre ses décisions critiques à un moment où tant de grossesses échouent. , dit Zernicka-Goetz.
Pour en savoir plus sur cette recherche, voir Événements moléculaires clés dans l’embryon humain en développement identifié.
Référence : « Une seule caractérisation de l’embryogenèse humaine identifie les transitions de pluripotence et le centre hypoblastique antérieur putatif » par Matteo A. Molè, Tim HH Coorens, Marta N. Shahbazi, Antonia Weberling, Bailey AT Weatherbee, Carlos W. Gantner, Carmen Sancho-Serra , Lucy Richardson, Abbie Drinkwater, Najma Syed, Stephanie Engley, Philip Snell, Leila Christie, Kay Elder, Alison Campbell, Simon Fishel, Sam Behjati, Roser Vento-Tormo et Magdalena Zernicka-Goetz, 17 juin 2021, Communication Nature.
DOI : 10.1038/s41467-021-23758-w
Matteo Molè de l’Université de Cambridge est le premier auteur de l’étude. En plus de Zernicka-Goetz, les co-auteurs supplémentaires sont Tim Coorens et Carmen Sancho-Serra du Wellcome Sanger Institute ; Marta Shahbazi, Antonia Weberling, Bailey Weatherbee et Carlos Gantner dans le laboratoire Zernicka-Goetz de l’Université de Cambridge ; les embryologistes Lucy Richardson, Abbie Drinkwater, Najma Syed et Stephanie Engley du Herts & Essex Fertility Center du Bishops College ; Philip Snell, Leila Christie et Kay Elder de Bourn Hall à Cambridge, Royaume-Uni ; Alison Campbell du groupe CARE Fertility à Nottingham, Royaume-Uni ; Simon Fishel du groupe CARE Fertility et de l’Université John Moores de Liverpool à Liverpool, Royaume-Uni ; et enfin, les collaborateurs chargés des analyses des données de séquençage : Sam Behjati du Wellcome Sanger Institute et de l’Université de Cambridge ; et Roser Vento-Tormo du Wellcome Sanger Institute. Le financement a été fourni par l’Organisation européenne de biologie moléculaire, le Conseil de recherche médicale de l’UKRI, le Gates Cambridge Trust, le Wellcome Trust et aux États-Unis par Open Philanthropy (Silicon Valley) et les fondations Curci et Weston Havens.