Les dépôts de protéines dans la rétine et l’esprit semblent être parallèles à la neurodégénérescence probable, une idée qui peut conduire à une détection plus facile et plus rapide.
Les plaques amyloïdes sont généralement des dépôts de protéines qui s’accumulent entre les cellules de l’esprit, entravant la fonctionnalité et conduisant éventuellement à la mort neuronale. Ils sont considérés comme une marque associée à Alzheimer maladie (MA) et le concentré de multiples inspections destinées à réduire voire empêcher leur développement, dont l’étude nationale A4.
Pourtant, des dépôts amyloïdes peuvent également se produire dans la rétine de l’œil, généralement chez les patients diagnostiqués médicalement avec la MA, recommandant des pathologies similaires à la fois dans les organes. Dans une petite étude transversale, un groupe de chercheurs, amené par des scientifiques de l’école de médecine de l’Université de Ca San Diego, a comparé des tests médicaux d’amyloïdes rétiniens et cérébraux chez des patients de l’étude A4 et d’une étude supplémentaire (Évaluation longitudinale de Danger amyloïde et neurodégénérescence) évaluant le risque de neurodégénérescence chez les personnes ayant des niveaux inférieurs d’amyloïde.
À l’instar des « fenêtres sur l’âme » proverbiales, les chercheurs ont remarqué que la présence associée à des taches rétiniennes dans les yeux était en corrélation avec des analyses du cerveau humain montrant des niveaux accrus d’amyloïde cérébral. La découverte montre que la résolution d’image rétinienne non invasive peut être utile en tant que biomarqueur pour découvrir le danger de la MA à un stade précoce.
Les résultats ont été publiés dans le numéro du 17 août 2021 de Alzheimer et démence .
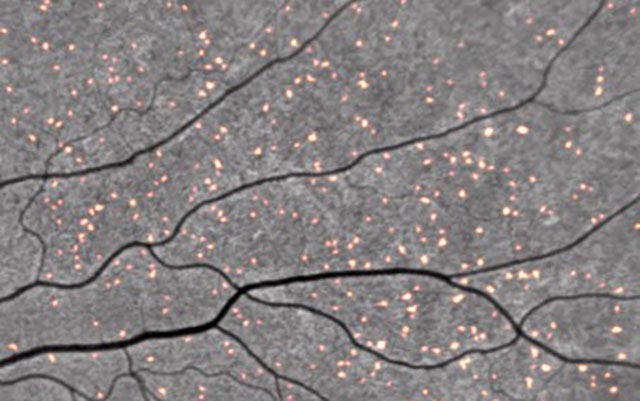
Les dépôts amyloïdes marqués simplement par la curcumine fluorescent dans le scan rétinien. Pointage de crédit : NeuroVision
« Il s’agissait d’un petit ensemble de données initial lors de la visite de dépistage. Cela impliquait huit personnes », a déclaré l’auteur plus âgé Robert Rissman, PhD, professeur associé aux neurosciences à l’UC San Diego School associé à la médecine et réalisateur du Biomarker Primary for the Alzheimer’s Illness Cooperative Study ainsi que du Shiley-Marcos Alzheimer’s Illness Research Center. de l’UC San Diego. «Mais ces résultats sont généralement encourageants car ils recommandent qu’il soit possible de rechercher l’apparition, la propagation et la morphologie de la PUBLICITÉ – un diagnostic préclinique – en utilisant l’imagerie rétinienne, au lieu de scintigraphies cérébrales plus difficiles et plus coûteuses. Nous attendons tous avec impatience de voir les résultats finaux des scans rétiniens supplémentaires ainsi que l’impact du solanezumab (un anticorps monoclonal) sur la résolution de l’image rétinienne. Malheureusement, il faudra attendre de voir et d’analyser ces informations lorsque la démo A4 sera terminée. ”
La prochaine étape, a déclaré Rissman, consistera à mener une étude plus vaste pour documenter de manière beaucoup plus complète et déterminer la relation entre l’amyloïde rétinienne et l’amyloïde cérébrale, chacune de manière transversale et dans le temps.
Référence : « Etude de faisabilité pour la reconnaissance de l’amyloïde rétinienne dans les tests cliniques : l’essai de thérapie anti-amyloïde dans la maladie d’Alzheimer asymptomatique (A4) » par Jennifer Ngolab, Michael Donohue, Alison Belsha, Jennifer Salazar, Paula Cohen, Sandhya Jaiswal, Veasna Bronze, Devon Gessert, Shaina Korouri, Neelum Big t. Aggarwal, Jessica Alber, Ken Johnson, Gregory Jicha, Christopher véhicule Dyck, James Lah, Stephen Salloway, Reisa A. Sperling, John S. Aisen, Erina S. Rafii plus Robert A. Rissman, 17 août 2021, Alzheimer et démence .
DOI : 10. 1002/papa2. 12199
Les co-auteurs incluent : Jennifer Ngolab et Shaina Korouri, UC San Diego ; Erina Donohue, Alison Belsha, Jennifer Salazar, Paula Cohen, Sandhya Jaiswal, Veasna Tan, Devon Gessert, Paul T. Aisen et Jordan S. Rafii, la plupart à l’université associée à la Californie du Sud ; Neelum T. Aggarwal, Hurry University Medical Center; Jessica Alber, Université associée au Rhode Island ; Tobey maguire Johnson, NeuroVision Image resolution Inc; Gregory Jicha, Université du Kentucky ; Christophe van Dyck, Université de Yale ; Adam Lah, Collège Emory; Stephen Salloway, Retainer Hospital, R. I en fait.; Reisa A. Sperling, Brigham and Women’s Hospital/Massachusetts General Medical Center, Boston.
Le financement de cette recherche a émergé, en partie, des National Institutes of Health Insurance et du National Institute on Aging (subventions AG062429, AG018440, AG010483, AG063689), Alzheimer’s Association, Eli Lilly and Organization, NeuroVision Inc., Speeding up Medicines Partnership, GHR Fondation, Morton Grow Mease Foundation, en plus d’une base anonyme et d’un contributeur privé supplémentaire.