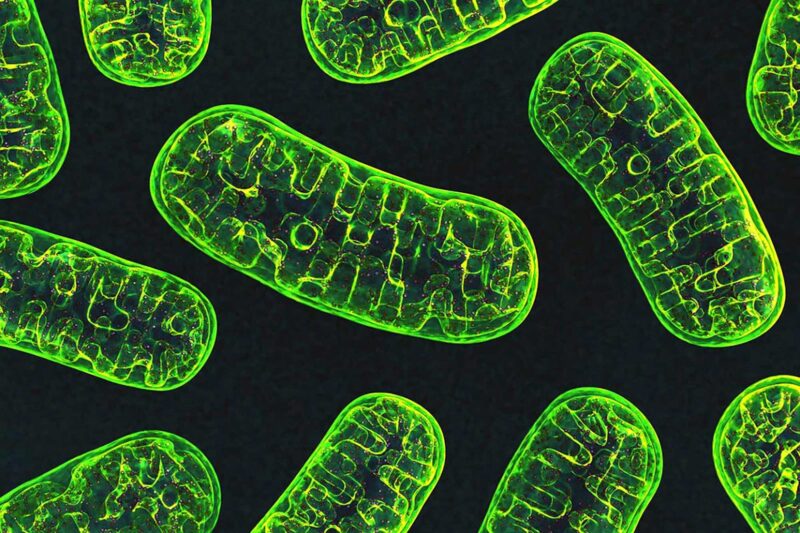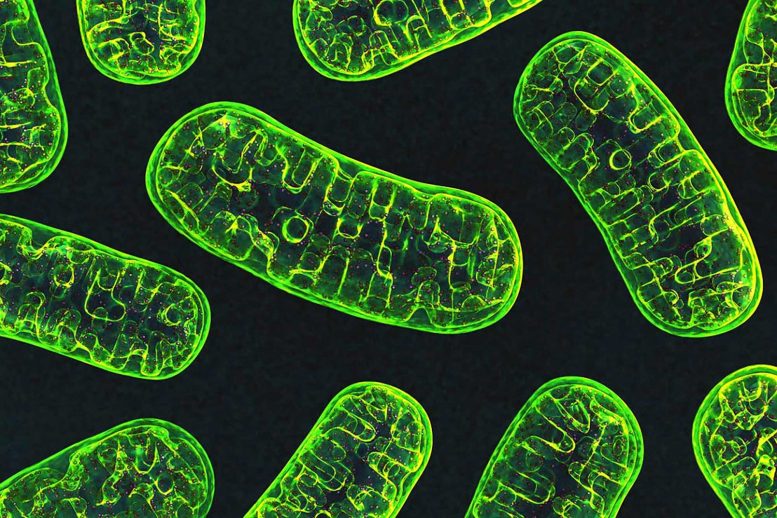
Les perturbations de la fission des mitochondries, les structures à l’intérieur des cellules qui produisent de l’énergie, sont à l’origine d’une multitude d’autres maladies, dont le cancer, le diabète et les maladies cardiaques. Crédit : National Institutes of Health
Une étude menée par l’UCLA sur le mécanisme qui provoque la division des mitochondries pourrait constituer une étape vers un traitement potentiel.
Alors que les scientifiques s’efforcent de trouver un traitement pour la maladie de Parkinson, une ligne de recherche qui a émergé se concentre sur les mitochondries, les structures à l’intérieur des cellules qui produisent de l’énergie. La santé de ces structures est maintenue par un système de contrôle de la qualité qui équilibre deux processus opposés : la fission – une mitochondrie se divisant en deux – et la fusion – deux devenant une seule.
Lorsqu’il y a un problème avec la fission, ce système est déséquilibré. Les conséquences peuvent être des maladies neurodégénératives, comme la maladie de Parkinson, et d’autres affections graves.
Depuis des années, les scientifiques savent qu’une protéine particulière, appelée Drp1, est un régulateur principal de la fission mitochondriale, mais ils savent peu de choses sur la façon dont Drp1 est contrôlée par d’autres protéines. Les processus essentiels en biologie sont régis par des réactions en chaîne biochimiques complexes entre ces protéines. Les scientifiques appellent ces réactions en chaîne des voies de signalisation.
Aujourd’hui, une collaboration de recherche dirigée par des chercheurs de l’UCLA a apporté un nouvel éclairage sur les mécanismes contrôlant Drp1 et la fission des mitochondries. Ces résultats pourraient faire progresser la lutte contre la maladie de Parkinson et diverses autres maladies.

Le Dr Ming Guo, auteur correspondant de l’étude et professeur de neurologie et de pharmacologie moléculaire et médicale à la David Geffen School of Medicine de l’UCLA. Crédit : Marc Roseboro/CNSI à UCLA
L’étude, publiée aujourd’hui (24 mars 2022) dans la revue Nature Communications, a révélé qu’une protéine chez l’homme appelée CLUH (prononcez “clue-H”) agit pour attirer Drp1 vers les mitochondries et déclencher la fission. Lors d’expériences menées sur des mouches à fruits génétiquement modifiées avec un analogue de la maladie de Parkinson, l’équipe a montré que les dommages causés par la maladie pouvaient être inversés en augmentant la quantité d’une protéine que les scientifiques appellent “clueless”, qui est l’équivalent de CLUH chez la mouche à fruits.
“Avec une voie d’importance critique comme Drp1, il pourrait y avoir plusieurs protéines que nous pourrions utiliser pour intervenir et finalement contrôler la maladie de Parkinson”, a déclaré le Dr Ming Guo, l’auteur correspondant de l’étude et professeur de neurologie et de pharmacologie moléculaire et médicale à la David Geffen School of Medicine de l’UCLA. “Lorsque nous avons modifié le cluedo chez les mouches, les symptômes analogues à ceux de la maladie de Parkinson se sont considérablement améliorés.”
Les recherches de Guo se concentrent sur les maladies neurodégénératives, mais les perturbations de la fission des mitochondries sont à l’origine d’une foule d’autres affections, notamment le cancer, le diabète et les maladies cardiaques, ainsi que certains défauts de développement qui entraînent la mort des nourrissons.
“Ces résultats devraient fournir des informations importantes à la communauté scientifique, non seulement pour comprendre les principes fondamentaux de la biologie, mais aussi pour améliorer la santé humaine”, a déclaré Guo, qui est également membre du California NanoSystems Institute à UCLA.
Les chercheurs ont étudié des réactions biochimiques en chaîne complexes chez des drosophiles, dans des cultures de cellules humaines et parmi des protéines dans un environnement sans cellules. Les environnements acellulaires permettent aux scientifiques d’observer les interactions entre les protéines dans un contexte simple.
Guo et ses collègues ont constaté que la perte de clueless (chez les drosophiles) ou de CLUH (dans les cellules humaines) donnait lieu à des mitochondries qui semblaient plus longues, tandis que de grandes quantités de protéines clueless ou CLUH donnaient lieu à des mitochondries fragmentées. Selon Guo, les mitochondries plus longues résultent probablement d’une fission trop faible, et les mitochondries fragmentées d’une fission trop importante.
Les drosophiles qui avaient été génétiquement modifiées pour être dépourvues de clueless – une manipulation qui réduit considérablement leur durée de vie – ont vécu jusqu’à quatre fois plus longtemps lorsque les chercheurs leur ont administré davantage de protéine Drp1. Ce rétablissement frappant indique que la capacité de clueless à contrôler la fission mitochondriale fonctionne par le biais de Drp1.
L’équipe a également montré que clueless chez les mouches et CLUH dans les cellules humaines recrutent Drp1 flottant librement à l’intérieur d’une cellule pour se fixer à des récepteurs à la surface des mitochondries. En outre, les chercheurs ont découvert que CLUH dans les cellules humaines aide à traduire les instructions génétiques présentes dans les messagers RNA into the protein for Drp1 receptors on the surface of mitochondria. More available Drp1 receptors means that more Drp1 can be recruited in order to trigger fission.
Guo’s research group is continuing to investigate how CLUH controls mitochondrial fission and its impact in cellular and organism health.
“In the future, we hope to identify a mechanism with such precision that it only affects Parkinson’s disease, so patients can derive maximum benefit,” she said.
Reference: “Clueless/CLUH regulates mitochondrial fission by promoting recruitment of Drp1 to 6 mitochondria” by Huan Yang, Caroline Sibilla, Raymond Liu, Jina Yun, Bruce A. Hay, Craig Blackstone, David C. Chan, Robert J. Harvey and Ming Guo, 24 March 2022, Nature Communications.
DOI: 10.1038/s41467-022-29071-4
The study’s first author is Huan Yang, a UCLA postdoctoral researcher. Other authors are Jina Yun, a former UCLA postdoctoral researcher; Caroline Sibilla, a former graduate student at the National Institutes of Health; Raymond Liu, Bruce Hay and David Chan of Caltech; Dr. Craig Blackstone of Harvard Medical School; and Robert Harvey of the University of Sunshine Coast in Australia.
The study was funded by the National Institutes of Health, the Wellcome Trust, the Glenn Foundation for Medical Research, the Louis B. Mayer Foundation, the Renee and Meyer Luskin Family Fund, the B. Freeman and R. Spogoli Fund for Aging and Neurodegeneration, and the UCLA Laurie and Steven Gordon Commitment to Cure Parkinson’s Disease.