Le plutonium, un métal lourd et argenté comportant 15 isotopes, produit par l’irradiation neutronique de l’uranium naturel, est un élément formidablement complexe qui ne se comporte pas toujours comme prévu. Une nouvelle recherche publiée dans la revue Physical Review B montre que le plutonium ne partage pas ses électrons lorsqu’il se lie à des atomes de fluor.

Cette image montre une pastille de dioxyde de plutonium-238. La pastille est rougeoyante en raison de la chaleur générée par la désintégration radioactive (principalement alpha) du combustible. Ces pastilles ont été utilisées dans les générateurs thermoélectriques à radio-isotopes qui ont alimenté les vaisseaux spatiaux Galilleo et Cassini de la NASA lors de leurs missions vers Jupiter et Saturne, respectivement. Crédit image : Los Alamos National Laboratory.
Le plutonium est un élément chimique radioactif transuranien de symbole Pu et de numéro atomique 94.
C’est un élément incroyablement complexe qui a des effets considérables sur l’énergie, la sécurité et l’environnement.
Pour en savoir plus sur le plutonium, l’auteur principal, le Dr Herman Cho du Pacific Northwest National Laboratory, et ses collègues se sont penchés sur un composé à la composition relativement simple : le tétrafluorure de plutonium (PuF4).
Si la formule est simple, les quatre liaisons se sont avérées plus complexes. Les électrons restent relativement proches de chaque atome, ce qui crée des liaisons ioniques, et non des liaisons covalentes avec partage d’électrons comme prévu.
Même si les atomes de plutonium et de fluor sont liés ensemble dans un réseau, ils agissent comme des atomes isolés et forment des liaisons ioniques.
“La liaison est l’une des grandes questions pour le plutonium et ses voisins actinides sur le tableau périodique”, a déclaré le Dr Cho.
“La réponse à cette question est d’une importance capitale car la chimie du plutonium dépend de la façon dont il se lie. PuF4 penche vers l’attraction électrostatique. Ce travail fournit une image plus claire de la raison de ce phénomène.”
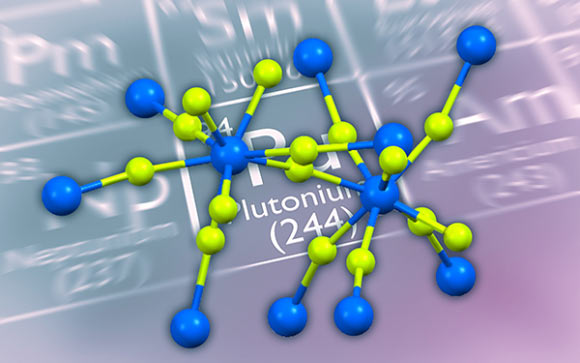
Structure du tétrafluorure de plutonium (PuF4).4) : Pu – bleu, fluor – vert. Crédit image : Cigdem Capan et al.
Les scientifiques ont commencé avec du PuF hautement radioactif4 provenant de l’usine de finition du plutonium de l’État de Washington, fermée depuis longtemps. Dans cette usine, ils ont créé des “boutons” de plutonium de la taille d’une rondelle de hockey.
Ils ont analysé le plutonium en utilisant la spectroscopie par résonance magnétique nucléaire (RMN), qui permet d’élucider les caractéristiques clés de la structure électronique près des centres du plutonium.
L’équipe a examiné les atomes du PuF4. Plus précisément, les chercheurs ont sondé les atomes de fluor autour des centres de plutonium pour mesurer les champs magnétiques produits par le plutonium (Pu4+), ce qui a révélé la façon dont les électrons étaient distribués dans l’échantillon.
Ils ont déterminé que les atomes de plutonium et de fluor ne sont pas particulièrement généreux.
Les deux atomes ont tendance à retenir leurs électrons, agissant plutôt comme des ions dans un sel où les forces électrostatiques maintiennent les atomes ensemble.
Cette recherche rapproche les scientifiques de la compréhension des nuances du plutonium et des autres actinides, d’autres éléments radioactifs proches du bas du tableau périodique.


