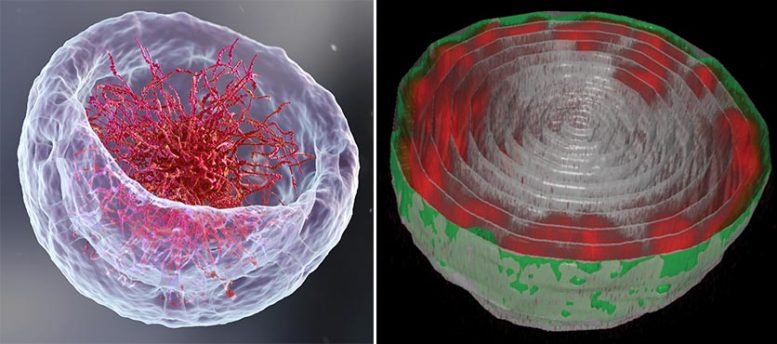
À gauche : une illustration 3D du noyau représentant la théorie classique de l’organisation de l’ADN en son centre. À droite : Retourner le bol de ramen sur la tête – Image microscopique du noyau d’une cellule musculaire de larve de mouche des fruits. Les longues chaînes d’ADN (rouge) sont attachées à la lame nucléaire (vert) – la couche interne de la membrane nucléaire. Crédit : Institut des sciences Weizmann
Aux abords du noyau
Si vous ouvrez un manuel de biologie et parcourez les images illustrant comment ADN est organisé dans le noyau de la cellule, il y a de fortes chances que vous commenciez à avoir faim ; les chaînes d’ADN ressembleraient à un bol de ramen : de longues chaînes flottant dans un liquide. Cependant, selon deux nouvelles études – une expérimentale[1] et l’autre théorique[2] – qui sont le fruit de la collaboration entre les groupes du Pr Talila Volk du Département de génétique moléculaire et du Pr Sam Safran du Département de physique chimique et biologique de l’Institut des sciences Weizmann, cette image est à reconsidérer. Le clarifier est essentiel car l’arrangement spatial de l’ADN dans le noyau peut affecter l’expression des gènes contenus dans la molécule d’ADN, et donc les protéines présentes dans la cellule.
Cette histoire a commencé lorsque Volk étudiait comment les forces mécaniques influencent les noyaux cellulaires dans le muscle et a trouvé des preuves que les contractions musculaires avaient un effet immédiat sur les modèles d’expression des gènes. « Nous n’avons pas pu explorer cela plus avant car les méthodes existantes reposaient sur l’imagerie de cellules chimiquement préservées, elles n’ont donc pas réussi à capturer ce qui se passe dans les noyaux cellulaires d’un muscle en fonctionnement réel », dit-elle.

(De gauche à droite) Pr Talila Volk, Pr Sam Safran, Dr Dana Lorber, Dr Daria Amiad-Pavlov et Dr Adriana Reuveny. S’éloigner du centre. Crédit : Institut des sciences Weizmann
Pour résoudre ce problème, le Dr Dana Lorber, associé de recherche dans le groupe de Volk, a dirigé la conception d’un appareil permettant d’étudier les noyaux musculaires des larves de mouches des fruits vivantes. L’appareil maintient la minuscule larve translucide dans une rainure qui lui permet de contracter et de détendre ses muscles, mais maintient son mouvement contraint afin qu’il puisse être scanné par un microscope à fluorescence. À l’aide de l’appareil, les chercheurs ont obtenu des images des complexes internes organisés de manière linéaire d’ADN et de ses protéines (appelées chromatine), entourés par la membrane des noyaux musculaires.
S’attendant à un bol plein de ramen, Lorber et le Dr Daria Amiad-Pavlov, stagiaire postdoctoral dans le groupe de Volk, ont été surpris. Plutôt que de remplir tout le volume du noyau, les « nouilles », ou longues molécules de chromatine, étaient organisées en une couche relativement mince, attachée à ses parois internes. Semblable au résultat de l’interaction entre l’huile et l’eau, ce qu’on appelle la « séparation de phases », la chromatine s’est séparée de la majeure partie du liquide à l’intérieur du noyau et a trouvé sa place à sa périphérie, tandis que la majeure partie du milieu fluide est restée au centre. Les chercheurs ont réalisé qu’ils étaient sur le point d’aborder une question biologique fondamentale, à savoir comment la chromatine, et donc l’ADN, est organisée dans le noyau d’un organisme vivant. «Mais les résultats étaient si inattendus que nous devions nous assurer qu’aucune erreur ne s’était glissée et que cette organisation était universelle», explique Lorber.
Les découvertes surprenantes abordent une question biologique fondamentale : comment l’ADN est-il organisé dans le noyau d’un organisme vivant.
Après avoir fait équipe avec le groupe de Safran, ils sont arrivés à la conclusion qu’il n’y avait pas eu d’erreur. Safran et son post-doctorant Dr. Gaurav Bajpai ont construit un modèle théorique qui inclut les facteurs physiques régissant l’organisation de la chromatine dans le noyau, tels que les forces d’attraction relatives entre la chromatine et son environnement liquide et entre la chromatine et la membrane nucléaire. Le modèle a prédit que la chromatine devrait subir une séparation de la phase liquide, en fonction de la quantité relative de liquide (hydratation) dans le noyau. De plus, la chromatine séparée en phases pourrait alors s’arranger le long de l’intérieur de la membrane nucléaire – tout comme l’équipe de Volk l’avait découvert dans leurs expériences.

Dr Gaurav Bajpai. Crédit : Institut des sciences Weizmann
Les groupes ont également expliqué pourquoi, dans des études antérieures menées par d’autres scientifiques, la chromatine semblait remplir les noyaux cellulaires. « Lorsque les scientifiques plaquent des cellules sur une lame de verre afin de les étudier au microscope, ils modifient leur volume et les aplatissent physiquement. Cela peut perturber certaines des forces régissant l’arrangement de la chromatine et réduire la distance entre la partie supérieure du noyau et sa base », explique Safran.
Pour s’assurer que ces résultats ne se limitent pas aux cellules musculaires de la mouche des fruits, Lorber et Amiad-Pavlov se sont associés au Dr Francesco Roncato du groupe du professeur Ronen Alon du département d’immunologie et ont examiné des globules blancs humains vivants. Dans ce cas également, la chromatine était organisée de la même manière en une couche tapissant la paroi nucléaire interne. “Cela a montré que ce que nous avions trouvé était probablement un phénomène général, et que cette organisation de la chromatine avait probablement été conservée tout au long de l’évolution”, explique Amiad-Pavlov.
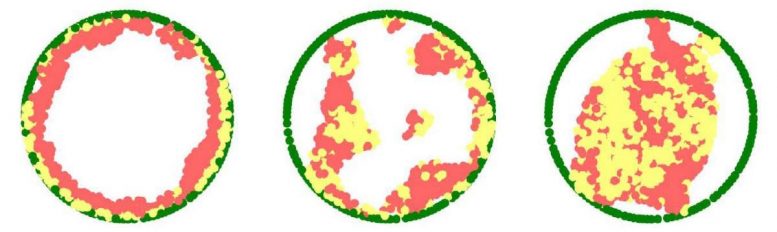
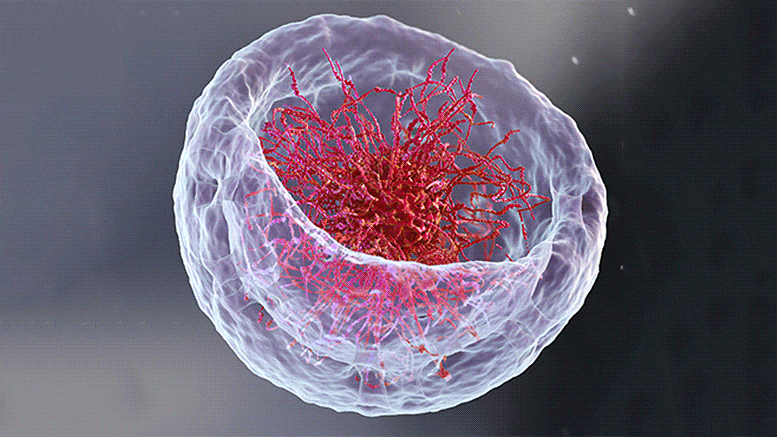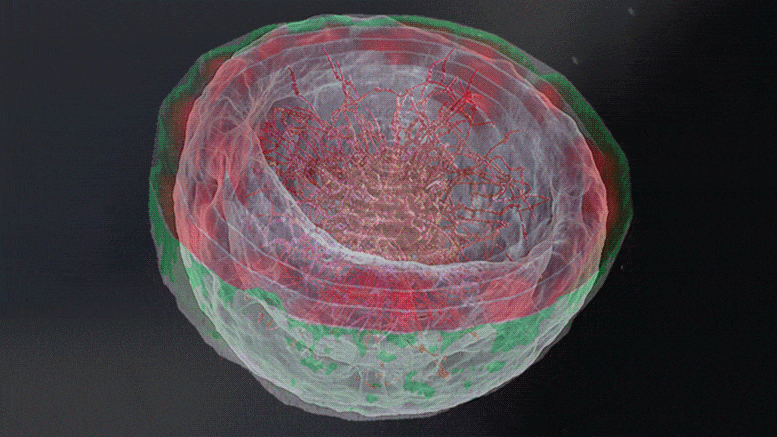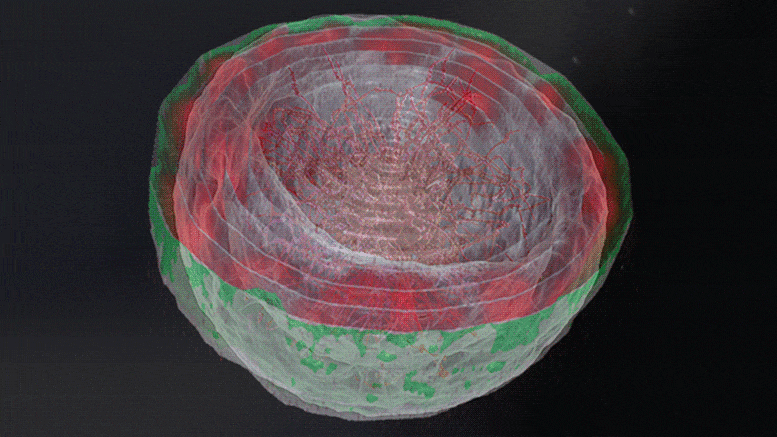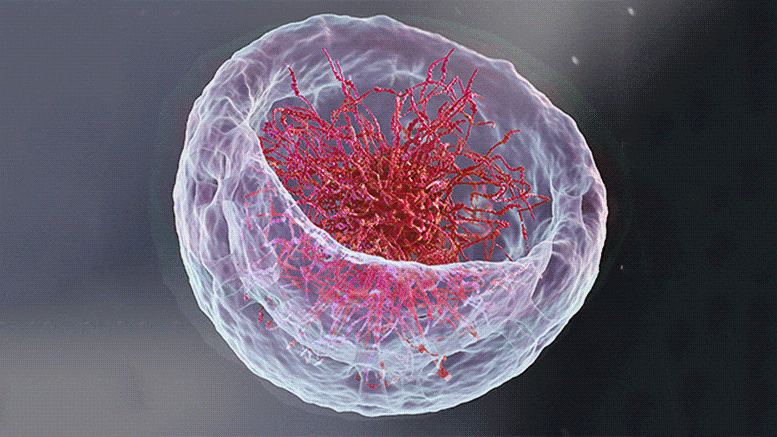
Les simulations 3D de la chromatine révèlent que l’organisation de la chromatine dans le noyau dépend de l’interaction physique entre la chromatine et la lame nucléaire. Lorsque ces interactions s’affaiblissent (de gauche à droite) – comme c’est le cas dans plusieurs maladies allant des dystrophies musculaires aux troubles neurologiques – la chromatine se déplace de la périphérie du noyau vers son centre. Crédit : Institut des sciences Weizmann
L’étude ouvre de nouvelles voies de recherche sur l’organisation de l’ADN dans la cellule et, par extension, sur les forces physiques qui agissent sur le noyau et la chromatine et qui peuvent affecter l’expression des gènes. Une direction potentielle consiste à explorer s’il existe une différence entre l’organisation de l’ADN dans la santé et la maladie. Si tel est le cas, cette différence peut être exploitée dans le diagnostic, par exemple, en tant que nouveau paramètre de détection des cellules cancéreuses. Dans l’étude du développement embryonnaire, l’exploration de l’organisation de l’ADN peut aider à déterminer si les forces mécaniques affectent la différenciation des cellules en de nouveaux destins. Enfin, on sait que la rigidité de la surface sur laquelle les cellules sont placées peut altérer l’expression de leurs gènes. La nouvelle étude suggère que cela pourrait avoir à voir avec la poussée et la traction de la surface sur la membrane nucléaire et l’impact qui en résulte sur l’organisation de l’ADN dans le noyau. Une meilleure compréhension de cette interaction peut aider à contrôler l’expression des gènes dans les cellules utilisées pour l’ingénierie des tissus avec les propriétés souhaitées.
On pensait que l’ADN et son emballage de chromatine remplissaient jusqu’à 60% du volume nucléaire. Dans leur étude, les scientifiques de l’Institut Weizmann ont trouvé qu’il était de 31 %.
Les références:
« L’imagerie en direct de la distribution de la chromatine révèle de nouveaux principes d’architecture nucléaire et de compartimentation de la chromatine » par Daria Amiad-Pavlov, Dana Lorber, Gaurav Bajpai, Adriana Reuveny, Francesco Roncato, Ronen Alon, Samuel Safran et Talila Volk, 2 juin 2021, Avancées scientifiques.
DOI : 10.1126 / sciadv.abf6251
« Séparation de phase à mésoéchelle de la chromatine dans le noyau » par Gaurav Bajpai, Daria Amiad Pavlov, Dana Lorber, Talila Volk et Samuel Safran, 4 mai 2021, eLife.
DOI : 10.7554 / eLife.63976
Le Dr Adriana Reuveny du groupe du professeur Talila Volk du département de génétique moléculaire a également participé à l’étude expérimentale.
La professeure Talila Volk est titulaire de la chaire professorale Sir Ernst B. Chain.
Les recherches du professeur Volk sont soutenues par le Centre Aharon Katzir-Katchalsky ; le Fonds de dotation Benoziyo pour l’avancement de la science ; et l’Institut Henry Chanoch Krenter pour l’imagerie biomédicale et la génomique.
Le professeur Samuel Safran est le titulaire de la Chaire professorale Fern & Manfred Steinfeld.
Les recherches du Pr Safran sont soutenues par l’Institut Henry Chanoch Krenter d’imagerie biomédicale et de génomique ; et la famille Harold Perlman