Une équipe de recherche dirigée par J. Nicholas Betley de la School of Arts & Sciences a identifié une toute nouvelle façon dont le cerveau signale la satiété après avoir mangé. Les résultats offrent une nouvelle cible pour les thérapies qui pourraient considérablement réduire la suralimentation.
Les personnes atteintes du syndrome de Prader Willi, une maladie génétique, ont un appétit insatiable. Ils ne se sentent jamais rassasiés, même après un repas copieux. Le résultat peut être une suralimentation et une obésité potentiellement mortelles.
Selon une nouvelle étude, leur faim constante résulte en partie d’une signalisation désordonnée dans le cervelet du cerveau, une région du cerveau également responsable du contrôle moteur et de l’apprentissage. Une équipe de recherche internationale couvrant 12 institutions, dirigée par J. Nicholas Betley, professeur adjoint de biologie à la Penn’s School of Arts & Sciences, et Albert I. Chen, professeur agrégé au Scintillion Institute, à San Diego, a utilisé des indices de Prader Willi patients pour guider les investigations chez la souris qui ont découvert un sous-ensemble de neurones cérébelleux qui signalent la satiété après avoir mangé.
Lorsque les chercheurs ont activé ces neurones, l’ampleur de l’effet « était énorme », selon Betley. Les animaux mangeaient aussi souvent que les souris typiques, mais chacun de leurs repas était 50 à 75 % plus petit.
Les signaux entre le cerveau et l’estomac aident les animaux à décider quand et combien manger. Une collaboration de recherche impliquant des neuroscientifiques de Penn a découvert un capteur de plénitude dans une zone du cerveau jamais associée à la satiété : le cervelet. Crédit : Avec l’aimable autorisation du laboratoire Betley
“C’était époustouflant”, dit-il. “En fait, c’était tellement époustouflant que j’ai pensé que ça devait être faux.” Betley a encouragé Aloysius Low, chercheur postdoctoral dans son laboratoire et premier auteur de l’étude, à mener un certain nombre d’autres expériences pour s’assurer que l’effet était réel. En près d’un an, ils ont été convaincus.
“C’est incroyable que vous puissiez encore trouver des zones du cerveau qui sont importantes pour les comportements de survie de base que nous n’avions jamais impliqués auparavant”, dit Betley. “Et ces régions du cerveau sont importantes de manière robuste.”
Le travail, partagé dans le journal La nature, suggère que les neurones des noyaux cérébelleux antérieurs profonds du cervelet (aDCN) sont impliqués pour aider les animaux à réguler la taille de leur repas.
Une nouvelle région
Depuis ses débuts, le laboratoire de Betley a démêlé une variété de circuits neuronaux liés à la façon dont le cerveau régule la prise alimentaire. Ce travail ainsi que d’autres recherches ont impliqué des zones du cerveau postérieur et de l’hypothalamus dans ce contrôle. “Mais nous savons aussi que les médicaments qui ciblent l’hypothalamus et le cerveau postérieur ne sont pas vraiment de bons traitements contre l’obésité”, déclare Betley.
Avec des collaborateurs qui étudient le cervelet humain, Roscoe Brady du Beth Israel Deaconess Medical Center à Boston et Mark Halko du McLean Hospital à Belmont, Massachusetts, Betley et Chen ont discuté de la possibilité que le cervelet puisse jouer un rôle dans la suppression de la faim. Les deux ont contacté Laura Holsen du Brigham and Women’s Hospital de Boston, qui disposait d’un rare ensemble de données contenant des IRM fonctionnelles – un moyen de suivre le flux sanguin dans le cerveau – des patients Prader Willi. Holsen avait utilisé les données pour répondre à d’autres questions liées aux circuits neuronaux du trouble, mais les chercheurs ont examiné les données sous un nouveau jour, recherchant des différences dans la façon dont le cerveau de ces patients répondait à la nourriture par rapport à un groupe non affecté.
« Le cervelet sort, » dit Betley, « et nous regardions tous cela en disant : « Est-ce réel ? » »
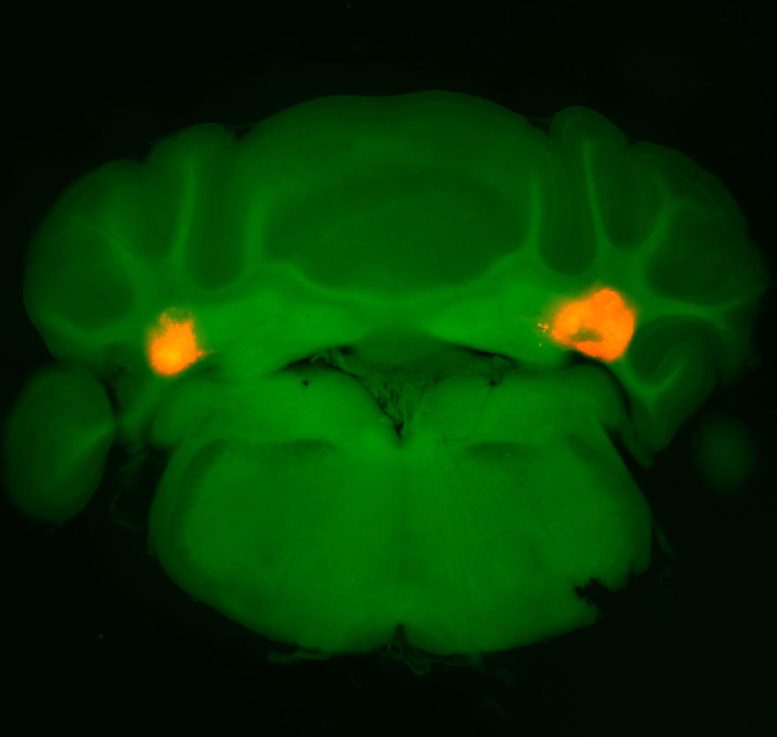
L’activation d’une population sélectionnée de neurones dans l’aDCN, une région du cervelet, a considérablement réduit l’apport alimentaire, selon les enquêtes de l’équipe. Crédit : Avec l’aimable autorisation du laboratoire Betley
En ce qui concerne les souris, l’analyse transcriptomique unicellulaire a confirmé qu’un petit sous-ensemble de neurones glutamatergiques dans l’aDCN étaient ceux qui étaient activés lors de l’alimentation. L’activation de ces seuls neurones aDCN a conduit les animaux à restreindre considérablement la taille de leur repas, qu’ils aient été privés de nourriture ou qu’ils aient reçu autant de nourriture qu’ils le souhaitaient auparavant. Lorsque les chercheurs ont fait l’inverse, en inhibant ces mêmes neurones, les souris ont mangé des repas plus gros que la normale. Bien que la réduction de l’apport alimentaire puisse souvent amener les humains et les animaux à compenser en mangeant plus de nourriture plus tard, les animaux stimulés par l’aDCN ne l’ont pas fait et les mesures de l’activité métabolique sont restées stables.
Les résultats étaient remarquables mais n’ont pas révélé ce que faisaient exactement les neurones. Est-ce qu’ils faisaient simplement manger moins aux animaux, ou étaient-ils impliqués pour les aider à prédire la quantité à manger ou à réguler l’alimentation en fonction d’autres commentaires ?
Un indice est venu du fait que lorsque des souris avec des neurones aDCN activés recevaient un aliment moins dense en calories que leur régime normal, elles mangeaient plus que la normale pour obtenir un nombre égal de calories. “Cela nous a dit que cet animal calcule le nombre de calories qu’il absorbe et s’arrête lorsqu’il pense qu’il en a assez”, explique Betley.
En se concentrant sur un sous-ensemble de neurones aDCN activés par l’alimentation, l’équipe de recherche a approfondi le rôle des neurones dans la régulation de la faim et de la satiété. Chez les animaux affamés, ces neurones se sont activés rapidement et fortement après avoir reçu de la nourriture; chez les animaux nourris, les neurones sont restés calmes.
Une pièce du puzzle
Dans une dernière série d’enquêtes, les chercheurs ont cherché à comprendre comment l’activité d’aDCN s’inscrivait dans ce qui était déjà connu sur les circuits de la faim et de la satiété dans le cerveau. Le laboratoire de Betley avait déjà étudié un groupe de neurones dans l’hypothalme, appelés neurones AgRP, qui sont activés lorsque les animaux sont en déficit calorique et sont responsables d’une alimentation accrue. Lorsque l’équipe a activé ces neurones en même temps que les neurones aDCN, les souris présentaient toujours une réduction spectaculaire de la prise alimentaire, suggérant que le cervelet signale dans une voie indépendante de l’hypothalamus.
Les comportements alimentaires peuvent également être déterminés par la récompense et le plaisir de manger, et donc Betley, Low et leurs collègues ont ensuite cherché à voir si la signalisation de la dopamine dans le striatrum ventral du cerveau, associée aux voies de « récompense » neurales, était affectée par l’activation d’aDCN. Ils ont découvert que lorsque les neurones aDCN associés à une alimentation réduite étaient activés, la dopamine inondait le striatum ventral. C’était déroutant, car l’augmentation de la signalisation de la dopamine pousse généralement les animaux à rechercher plus de récompenses.
Pour mieux comprendre la relation entre la signalisation de la dopamine et l’activité aDCN, les chercheurs ont activé les neurones aDSC des souris pendant une heure avant de les nourrir. Alors que les souris ont normalement un pic de niveaux de dopamine après avoir reçu de la nourriture, les souris activées par aDCN ont eu une augmentation de dopamine sévèrement entravée.
“D’autres personnes ont vu que lorsque vous activez les neurones dopaminergiques avec de la dopamine, ou enlevez la dopamine, l’animal mange moins”, explique Betley. “Il peut y avoir un principe Boucle d’or, s’assurer que vous mangez juste assez.” Trop de dopamine bloque le pic de dopamine qui s’ensuit vers les récompenses, modifiant finalement le comportement, dit-il.
“Nous pensons que c’est pourquoi l’animal arrête de manger”, dit Betley. “Ce n’est plus assez gratifiant pour continuer.”
Ces découvertes peuvent guider des stratégies thérapeutiques pour atténuer la « récompense » que les patients atteints du syndrome de Prader Willi obtiennent en mangeant, en aidant à gérer leur faim incontrôlable. “Nous sommes ravis de traduire ces résultats chez les humains en utilisant la stimulation cérébrale non invasive avec Holsen, Halko et Brady”, a déclaré Betley. Une telle approche pourrait également offrir un moyen de traiter l’obésité.
Dans les travaux en cours, Betley et ses collègues visent à continuer à fournir des informations détaillées sur le contrôle réglementaire de la faim, contribuant ainsi à une image globale plus complète de la façon dont la faim et la satiété sont régulées dans le cerveau.
Référence : « Identification inverse-traductionnelle d’un réseau de satiété cérébelleuse » par Aloysius YT Low, Nitsan Goldstein, Jessica R. Gaunt, Kuei-Pin Huang, Norliyana Zainolabidin, Alaric KK Yip, Jamie RE Carty, Ju Y. Choi, Alekso M. Miller, Helen ST Ho, Clara Lenherr, Nicholas Baltar, Eiman Azim, Octobre M. Sessions, Toh Hean Ch’ng, Amanda S. Bruce, Laura E. Martin, Mark A. Halko, Roscoe O. Brady Jr, Laura M. Holsen, Amber L. Alhadeff, Albert I. Chen et J. Nicholas Betley, 17 novembre 2021, La nature.
DOI : 10.1038 / s41586-021-04143-5
En plus de Betley, Low, Chen, Brady, Halko et Holsen, les coauteurs de l’article étaient Penn’s Nitsan Goldstein, Jamie RE Carty, Ju Y. Choi, Alekso M. Miller et Clara Lenherr; Jessica R. Gaunt de l’Université technologique de Nanyan, Norliyana Zainolabidin, Helen ST Ho, Alaric KK Yip et Toh Hean Ch’ng ; Kuei-Pin Huang et Amber L. Alhadeff du Monell Chemical Senses Center ; Nicholas Baltar et Eiman Azim du Salk Institute; les sessions de M. d’octobre de l’Université nationale de Singapour ; et Amanda S. Bruce et Laura E. Martin de l’Université du Kansas Medical Center. Low est le premier auteur, et Chen et Betley sont les auteurs co-correspondants.
L’étude a été financée en partie par la National Science Foundation (Grant 1845298), les National Institutes of Health (subventions NS105555, NS111479, NS112959, MH111868, MH125995, MH116170, DK104772, DK119574, DK114104 et DK124801), Searle Scholars Program, Pew Trusts, McKnight Foundation, Klingenstein Simons Fellowship Award, American Heart Association (subventions 857082 et 17SDG33400158), American Diabetes Association (118IBS116), Whitehall Foundation, Warwick-NTU Neuroscience Programme et ministère de l’Éducation de Singapour (MOE2018-T2-1-065 et MOE2017-T3-1-002).