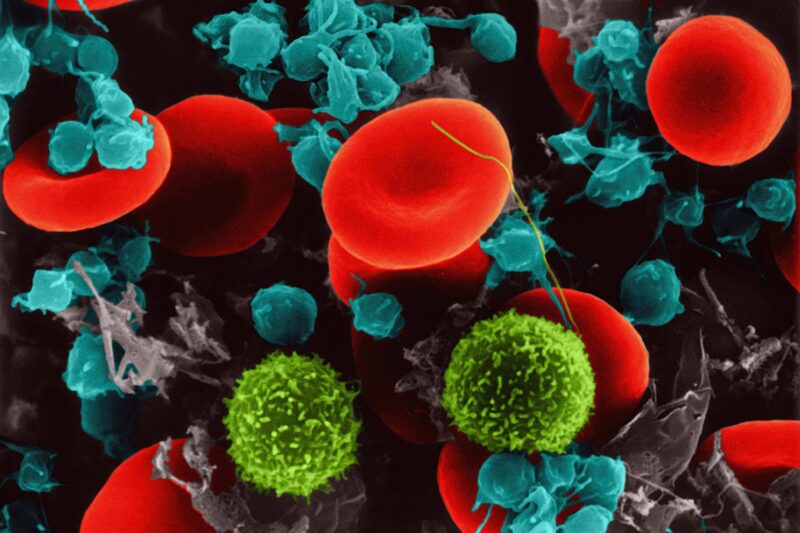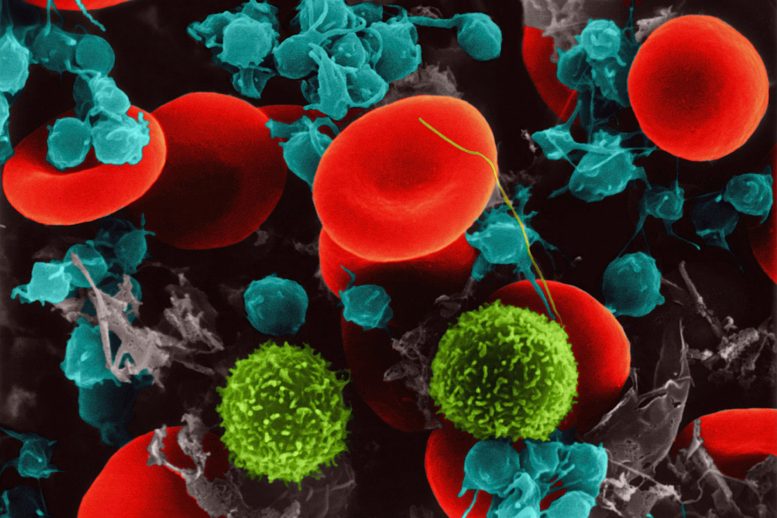
Diaphonie irrégulière entre les plaquettes sanguines et les tissus tapissant les vaisseaux sanguins toute cause de lésions mortelles des organes du corps chez les personnes atteintes de graves COVID-19[feminine , une nouvelle étude découvre.
Dirigée uniquement par des chercheurs de la NYU Grossman School of Medicine, l’étude a découvert les indicateurs protéiques dégagés par les plaquettes, les cellules brisées qui contribuent à la coagulation du sang, créent un gonflement, une coagulation anormale et des dommages aux vaisseaux lorsqu’ils sont exposés au virus de l’épidémie.
Sorti en ligne le 8 septembre en Avancées scientifiques , les travaux ont identifié 2 gènes apparentés, S1000A8 et S1000A9, qui sont retrouvés dans les plaquettes des personnes atteintes de COVID-19, les amenant à créer davantage de protéines saines liées aux myéloïdes (MRP) 8 plus 14. Une quantité plus élevée de deux protéines, reconnues pour fonctionner comme un ensemble et être présents en quantités considérables dans les tissus immunitaires, ont été liés dans l’étude à des degrés plus élevés de coagulation et de gonflement dans les vaisseaux, une meilleure gravité de la maladie et des séjours hospitaliers plus longs.
À l’appui de l’idée que les plaquettes sont dans le noyau associé aux dommages aux vaisseaux sanguins dans COVID-19, l’équipe d’étude a également montré des preuves que les médicaments autorisés connus pour empêcher l’activation des plaquettes avec les protéines de surface des plaquettes P2Y Douze (clopidogrel ou ticagrelor) a diminué l’inflammation liée au COVID-19 dans les vaisseaux. L’étude a également montré que les plaquettes exposées au COVID-19 modifient les cellules recouvrant les vaisseaux sanguins (cellules endothéliales) en grande partie par le biais d’une protéine appelée p-sélectine, rendant les plaquettes plus collantes et beaucoup plus susceptibles de former des caillots.
«Nos résultats révèlent une nouvelle fonction des plaquettes dans les dommages causés par les bateaux sanguins COVID-19, et peuvent clarifier en grande partie ce qui rend le virus COVID-19 particulier beaucoup plus mortel que les parents qui entraînent le rhume», explique l’écrivain correspondant Tessa Barrett, PhD, enseignant assistant de recherche dans le département associé à la médecine à NYU Langone Health.
Mieux savoir
Une inflammation inhabituelle à l’échelle du corps et une coagulation sanguine ont été identifiées au début de la pandémie comme les principales caractéristiques d’un COVID-19 sévère, les deux étant considérés comme interdépendants, selon les auteurs de la recherche. En tant que composants de la circulation sanguine qui réagissent aux blessures dans les navires en déclenchant un gonflement et en devenant collants les uns avec les autres en caillots, les plaquettes ont été suggérées comme étant à l’origine des dommages constatés. De plus, les preuves s’accumulent que l’interaction entre les plaquettes et le matériel cellulaire endothélial peut être importante pour ces types de mécanismes pathologiques.
Pour la recherche actuelle, les cellules endothéliales à travers de petits vaisseaux sanguins ont été exposées à du liquide lancé par les plaquettes associées à des individus COVID-19 ou à des patients en bonne santé comparables (contrôles). Le matériel génétique particulier ( ARN ) a ensuite été séquencé pour lire l’ordre particulier des « lettres » moléculaires constituant les règles de la génétique active (transcriptions) dans chaque cas. Dans l’existence de plaquettes activées par COVID-19, des changements ont été remarqués dans l’activité des cellules endothéliales exposées à toutes, avec 485 transcrits rendus moins énergétiques et 803 en ont résulté. Les gènes exprimés de manière différente dans COVID-19 avaient été lié à la coagulation, à l’irritation et à l’affaiblissement associé aux jonctions entre les cellules endothéliales, ce qui permet une fuite de sérum sanguin dans les tissus afin de provoquer l’œdème pulmonaire observé dans les cas graves, où les poumons des patients se remplissent de liquide.
À partir de votre grande liste initiale de coupables potentiels, le recoupement avec les bases de données a réduit la liste des candidats à deux idées liées au matériel génétique : S100A8 et S100A9, qui ont codé pour votre construction de MRP 8 et quatorze. Il a été découvert que la présence de COVID-19 chez les patients augmentait de 166% la quantité de MRP8/14 produite par les plaquettes ainsi que par d’autres cellules par rapport aux individus sans infection. Des niveaux accrus de MRP8/14 ont été liés à une coagulation anormale (thrombose), à une inflammation et à une maladie grave chez les patients hospitalisés avec COVID-19. Curieusement, la régulation à la hausse de S100A8/A9 ne s’est pas produite après l’exposition directe des plaquettes à un parent du virus de l’épidémie, le CoV-OC43, qui à son tour provoque le rhume.
En outre, le groupe de recherche a découvert que des lésions endothéliales induites par les plaquettes et une coagulation anormale pouvaient se produire par le mouvement de la p-sélectine dans les composants plaquettaires appelés granules alpha. Habituellement située à l’intérieur des granules α, la p-sélectine « bascule » vers l’extérieur lorsque les plaquettes sont activées, exactement là où elle favorise l’agglutination particulière des plaquettes et des signaux qui augmenteront la réponse de défense locale.
Les chercheurs ont également trouvé l’anticoagulant P2Y 12 les inhibiteurs ont réduit l’expression particulière de S100A8 et S100A9 dans les plaquettes de dix-huit pour cent sur 4 semaines, et dans les tests de laboratoire ont évité les plaquettes COVID-19 en induisant des dommages aux bateaux sanguins.
“L’étude actuelle facilite la théorie selon laquelle les plaquettes activent les cellules endothéliales par le biais de la P-sélectine, et que la p-sélectine et le MRP8/14 provoquent des dommages aux vaisseaux ainsi qu’un risque accru associé à la mort”, déclare Jeffrey S. Berger, rédacteur principal de l’étude. , MD, directeur du Center for the Avoidance of Cardiovascular Disease du NYU Grossman College of Medicine, ainsi que professeur de médecine et de chirurgie. « Comme notre équipe dirige également le marketing de réseau ACTIV4a, un grand test anticoagulant continu financé par le NIH dans COVID-19, nous testons actuellement chez les patients si les inhibiteurs de P2Y12 peuvent beaucoup mieux prévenir les maladies graves, avec les résultats pour finir présenté lors de la réunion annuelle de la United States Heart Association en novembre. »
ACTIV-4a commencera également bientôt à tester l’effet de l’inhibiteur de la sélectine P connu sous le nom de crizanlizumab chez les personnes hospitalisées avec COVID-19, a déclaré Berger. Se concentrer sur la P-sélectine peut empêcher à la fois le service des plaquettes et des cellules endothéliales, ainsi que leurs relations – où les inhibiteurs de P2Y12 ne s’attaquent qu’aux plaquettes.
Recherche : « Les plaquettes amplifient l’endothéliopathie dans le COVID-19 » simplement par Tessa J. Barrett, MacIntosh Cornwell, Khrystyna Myndzar, Christina D. Rolling, Yuhe Xia, Kamelia Drenkova, Antoine Biebuyck, Alexander To. Fields, Michael Tawil, Elliot Luttrell-Williams, Eugene Yuriditsky, Grace Jones, Paolo Cotzia, Matt D. Neal, Lucy Z. Kornblith, Stefania Pittaluga, Amy Sixth est contre Rapkiewicz, Hannah Mirielle. Burgess, Ian Mohr, Kenneth A. Stapleford, Deepak Voora, Kelly Ruggles, Judith Hochman et Jeffrey H. Berger, 8 septembre 2021, Avancées scientifiques .
DOI : 10. 1126/sciadv. abh2434
Avec Barrett et Berger, les auteurs de l’étude NYU Langone Wellness étaient MacIntosh Cornwell, Khrystyna Myndzar, Christina Moving, Yuhe Xia, Kamelia Drenkova, Antoine Biebuyck, Michael Tawil, Elliot Luttrell-Williams, Eugene Yuriditsky et Judith Hochman dans le département associé à Médicament; Kelly Ruggles à l’Institut de Génétique des Systèmes, Paolo Cotzia, à la Division de Pathologie ; Amy Rapkiewicz, professeure adjointe, Département de pathologie à l’hôpital NYU Langone Long Isle; et Hannah Burgess, Ian Mohr et Kenneth Stapleford du département associé à la microbiologie. Les écrivains étaient également Alexander Areas, Lucy Kornblith et Stefania Pittaluga au Département de chirurgie de l’Université de Californie à San Francisco; Sophistication Smith du Middle for Cancer Study au sein du National Malignancy Institute, Matthew Neal du département associé à la chirurgie du College of Pittsburgh, ainsi que Deepak Voora du Duke Center destiné à la génomique appliquée et à la médecine de précision avec le Duke University College of Medicine.
L’étude a été financée par des subventions ou des prêts des National Institutes of Health 1OT2HL156812-01, R35HL144993, R35GM119526, R01HL118049, 1T32GM136573-01, UL1TR001445 et P30CA016087 ; Offre de la Heart Association des États-Unis 18CDA34110203AHA, offre de la Communauté américaine d’hématologie 18-A0-00-1001884, subvention de la Deutsche Forschungsgemeinschaft (Fondation allemande pour la recherche) RO 6121/1-1 ; ainsi que par le financement du National Middle for Advancing Translational Sciences (NCATS).