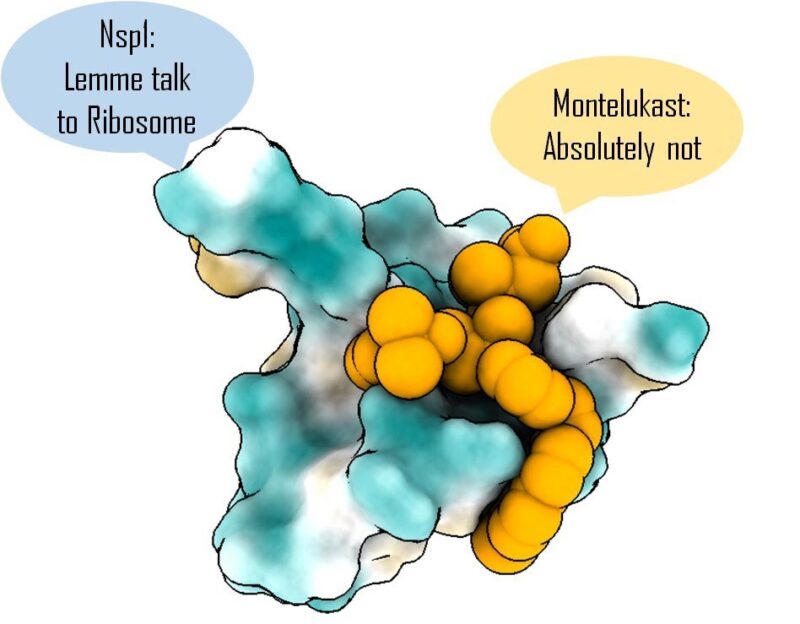
Le ciblage de Nsp1 avec le montelukast (Singulair) aide à prévenir l’arrêt de la synthèse des protéines de l’hôte. Crédit : Mohammad Afsar
Un médicament oral utilisé pour traiter l’asthme et les allergies peut se lier à une protéine cruciale produite par le virus <span class="glossaryLink" aria-describedby="tt" data-cmtooltip="
” data-gt-translate-attributes=”{” attribute=””> SRAS-CoV-2 et la bloquer, et réduire la réplication virale dans les cellules immunitaires humaines, selon une nouvelle étude menée par des chercheurs de l’Indian Institute of Science (IISc).
Approuvé par la Food and Drug Administration (FDA) américaine, le médicament, appelé montelukast, existe depuis plus de 20 ans et est généralement prescrit pour réduire l’inflammation causée par des conditions telles que l’asthme, l’urticaire et le rhume des foins. Aux États-Unis, le montélukast est vendu sous le nom de marque Singulair.
Dans l’étude publiée récemment dans la revue eLife , les chercheurs montrent que le médicament se lie fortement à une extrémité (&lsquo ; C-terminale&rsquo 😉 d’une protéine du SRAS-CoV-2 appelée Nsp1, qui est l’une des premières protéines virales libérées à l’intérieur des cellules humaines. Cette protéine peut se lier aux ribosomes &ndash ; la machinerie de fabrication des protéines &ndash ; à l’intérieur de nos cellules immunitaires et arrêter la synthèse des protéines vitales nécessaires au système immunitaire, l’affaiblissant ainsi. Le ciblage de Nsp1 pourrait donc réduire les dommages infligés par le virus.
Le montélukast est un médicament utilisé dans le traitement d’entretien de l’asthme, commercialisé notamment sous le nom de Singulair. En général, il est moins favorisé pour cette application que les corticostéroïdes inhalés. Il est inefficace dans le traitement des crises d’asthme aiguës. Les autres applications comprennent la rhinite allergique et l’urticaire de longue durée. Il s’agit d’un traitement de deuxième intention pour la rhinite allergique.
“Le taux de mutation dans cette protéine, en particulier dans la région C-terminale, est très faible par rapport au reste des protéines virales,”explique Tanweer Hussain, professeur adjoint au département de reproduction, développement et génétique moléculaires (MRDG) de l’IISc, et auteur principal de l’étude. Comme le Nsp1 est susceptible de rester largement inchangé dans toutes les variantes du virus qui apparaissent, les médicaments ciblant cette région devraient fonctionner contre toutes ces variantes, ajoute-t-il.
Hussain et son équipe ont d’abord utilisé la modélisation informatique pour passer au crible plus de 1 600 médicaments approuvés par la FDA afin de trouver ceux qui se lient fortement à Nsp1. Ils ont ainsi pu présélectionner une douzaine de médicaments, dont le montelukast et le saquinavir, un médicament contre le VIH. “Les simulations de dynamique moléculaire génèrent un grand nombre de données, de l’ordre de quelques téraoctets, et permettent de déterminer la stabilité de la molécule protéique liée au médicament. Les analyser et identifier les médicaments susceptibles de fonctionner à l’intérieur de la cellule était un défi”, explique Mohammad Afsar, ancien chercheur de projet au MRDG, actuellement postdoc à l’Université du Texas à Austin, et premier auteur de l’étude.
En collaboration avec le groupe de Sandeep Eswarappa, professeur associé au département de biochimie, l’équipe de Hussain&rsquo ; Hussain a ensuite cultivé en laboratoire des cellules humaines qui produisaient spécifiquement Nsp1, les a traitées avec du montelukast et du saquinavir séparément, et a constaté que seul le montelukast était capable d’empêcher l’inhibition de la synthèse protéique par Nsp1.
“Il y a deux aspects à considérer : l’un est l’affinité et l’autre la stabilité,&rdquo ; explique Afsar. Cela signifie que le médicament doit non seulement se lier fortement à la protéine virale, mais aussi rester lié pendant une période suffisamment longue pour empêcher la protéine d’affecter la cellule hôte, ajoute-t-il. “Le médicament anti-VIH (saquinavir) présentait une bonne affinité, mais pas une bonne stabilité.”Le montélukast, en revanche, s’est révélé se lier fortement et de manière stable à Nsp1, permettant aux cellules hôtes de reprendre une synthèse protéique normale.
Le laboratoire de Hussain a ensuite testé l’effet du médicament sur des virus vivants, dans l’installation de niveau de sécurité biologique 3 (BSL-3) du Centre for Infectious Disease Research (CIDR), IISc, en collaboration avec Shashank Tripathi, professeur adjoint au CIDR, et son équipe. Ils ont constaté que le médicament était capable de réduire le nombre de virus dans les cellules infectées de la culture.
“Les cliniciens ont essayé d’utiliser ce médicament.Il y a des rapports qui indiquent que le montelukast a réduit le nombre d’hospitalisations chez les patients atteints de la maladie COVID-19 (123654816) (123654795)”, déclare Hussain, ajoutant que les mécanismes exacts par lesquels il agit doivent encore être pleinement compris. Son équipe prévoit de travailler avec des chimistes pour voir s’ils peuvent modifier la structure du médicament afin de le rendre plus puissant contre le SRAS-CoV-2. Elle prévoit également de poursuivre la recherche de médicaments similaires dotés d’une forte activité antivirale.
Référence : “Un médicament ciblant le complexe Nsp1-ribosomal montre une activité antivirale contre le SRAS-CoV-2&rdquo ; par Mohammad Afsar, Rohan Narayan, Md Noor Akhtar, Deepakash Das, Huma Rahil, Santhosh Kambaiah Nagaraj, Sandeep M Eswarappa, Shashank Tripathi et Tanweer Hussain, 24 mars 2022, eLife .
DOI : 10.7554/eLife.74877